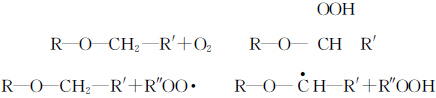Welchen Einfluss hat das UV-Monomer auf die UV-härtbare Sauerstoffsperre?
1.2 Probenvorbereitung und -prüfung
Das Monomer und der Initiator wurden genau abgewogen, wobei das Monomer nicht gereinigt wurde, und mit einem Magnetrührer gleichmäßig vermischt. Die UV-DSC wurde zur Durchführung von UV-Härtungsexperimenten unter statischer Luft- und Stickstoffatmosphäre verwendet, und die Proben wurden jedes Mal in gleichen Mengen entnommen, so dass die Dicke der Proben im Tiegel gleich war. Das UV-DSC-Programm wurde so eingestellt, dass die Probentemperatur 2 Minuten lang konstant gehalten wurde, dann wurde die Lichtquelle automatisch durch das Programm eingeschaltet, und das UV-Licht (Wellenlängenbereich 325-400 nm) wurde durch die Glasfaser in die DSC-Zelle eingeführt, um den Probentiegel und den Referenztiegel zu beleuchten, und die DSC maß den Wärmestromwert des Photohärtungsprozesses der Probe. Die Lichtintensität wurde mit 48,27 mW-cm-2 gemessen. Die Lichtintensität wurde bestimmt, indem Ruß auf den Boden des Probentiegels gestreut wurde, und die vom Licht absorbierte Energie wurde mit der UV-DSC gemessen und durch die Bodenfläche des Tiegels geteilt, um die Lichtintensität zu erhalten.
2 Ergebnisse und Diskussion
2.1 Datenverarbeitung
Die Lichthärtungsrate wurde wie folgt berechnet
Die Lichthärtungsrate R=dC/dt=(dH/dt)/Hmax, wobei dH/dt der Wärmestromwert auf der Kurve der Enthalpie über der Zeit des Lichthärtungsprozesses, gemessen mit UV-DSC, ist; Hmax ist die Gesamtpolymerisationswärme der Probe bei 200 s Lichtexposition, erhalten durch Integration des exothermen Peaks der Lichthärtung. Die Zeit, die der maximalen Aushärtungsrate des Lichthärtungsprozesses entspricht, ist tmax. Radikalische Polymerisation wird automatisch auftreten, beschleunigt Phänomen, das Licht Aushärtung Kurve zur Zeit abzuleiten, den maximalen Wert der Kurve entsprechend der Zeit als tamax aufgezeichnet, kann diese Zeit als die am schnellsten wachsende Zeit der Lichthärtung Rate betrachtet werden, zu diesem Zeitpunkt das System Sauerstoff blockiert und Käfig-Effekt und andere Faktoren auf den Verbrauch von primären Radikalen auf ein Minimum. Das freie Radikal initiierende Monomer beginnt schnell zu polymerisieren.
Berechnung des Initiatorgehalts (Molenbruch) α in der Probe:
Dabei ist n Initiator die molare Menge des Initiators im System, f ist der Funktionsgrad des Monomers, und n Monomer ist die molare Menge des Monomers im System. Abbildung 1 zeigt die Molekularstruktur des Initiators Irgacure-184, bei dem es sich um einen Spalttyp handelt, und die "2" in der Formel (1) bedeutet, dass ein Molekül des Initiators theoretisch durch Lichteinwirkung in zwei Moleküle von Radikalen zersetzt werden kann.
Die Strukturformel von Irgacure-184
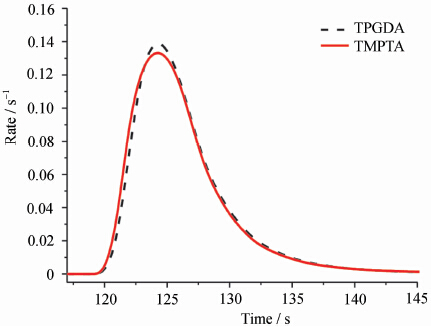
Abbildung 2 zeigt die Geschwindigkeitskurven verschiedener Monomer-Lichthärtung bei 4%-Initiatorgehalt (Massenanteil). Wie aus der Abbildung ersichtlich ist, gibt es für verschiedene Monomere Unterschiede in der Aushärtungsrate in der Vorhärtungsperiode, und dieser Unterschied wird auch in der Zeit ausgedrückt, was darauf hinweist, dass verschiedene Monomer-UV-Härtung in der Zeit Unterschiede in der Geschwindigkeit. Die Zeit tamax, zu der die Lichthärtungsrate des Monomers am schnellsten wächst, und die Zeit tmax, die der maximalen Lichthärtungsrate entspricht, werden mit der Variationskurve des Initiatorgehalts verglichen, und die Ergebnisse sind in Abbildung 3 dargestellt.
UV-Härtungsgeschwindigkeitskurven verschiedener Monomere mit 4%-Initiator
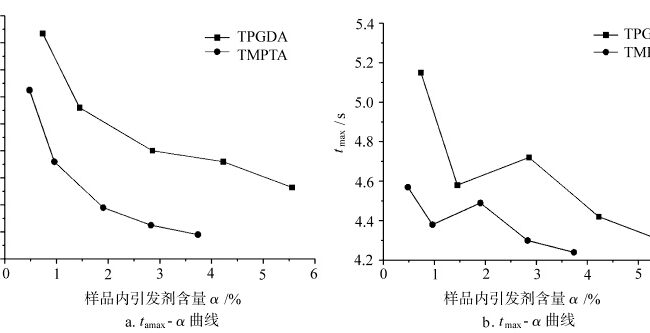
Das Verhältnis von tamax und tmax mit dem Initiatorgehalt bei der Aushärtung verschiedener Monomere an der Luft
Abbildung 3 zeigt die Kurven von tmax und tamax für die Lichthärtung verschiedener Monomere unter Luft als Funktion des Initiatorgehalts α in der Probe. In der frühen Phase der Aushärtung, wenn Sauerstoff vorhanden ist, wird ein Teil der reaktiven Radikale, die vom Photoinitiator durch Licht erzeugt werden, durch den in der Probe gelösten Sauerstoff verbraucht, während der andere Teil die Monomerpolymerisation einleitet. Der Sauerstoffblockierungseffekt verbraucht die durch die Zersetzung des Initiators und der Monomerradikale erzeugten Radikale und beeinflusst so die Größe von tamax und tmax der Lichthärtung, was wiederum die Empfindlichkeit der Lichthärtung gegenüber Sauerstoff und dem Initiatorgehalt widerspiegelt. Wie in Abb. 3a zu sehen ist, nimmt der tamax-Wert der Lichthärtung jedes Monomers mit zunehmendem Initiatorgehalt in einem bestimmten Muster ab. In Abb. 3b zeigt die tmax jedes Monomers bei der Lichthärtung eine gewisse Fluktuation mit der Erhöhung des Initiatorgehalts. Dies ist darauf zurückzuführen, dass das System bei Erreichen der maximalen Aushärtungsgeschwindigkeit einen hohen Aushärtungsgrad erreicht hat und die Molekülkettensegmente aufgrund des Glaseffekts allmählich eingefroren werden, so dass die Empfindlichkeit der tmax der Lichthärtungsreaktion gegenüber dem Initiatorgehalt zu diesem Zeitpunkt abnimmt. Während Tamax in der frühen Phase der Lichthärtung, wenn das System nicht hochgradig aushärtet, ist die Lichthärtungsreaktion empfindlicher auf den Gehalt des Initiators im System. Daher spiegelt Tamax im Vergleich die Empfindlichkeit der Lichthärtung gegenüber dem Initiatorgehalt besser wider.
2.2 Einfluss der Atmosphäre auf den lichthärtenden Tamax verschiedener Monomere
In Luftatmosphäre sollte die Tamax des photohärtenden Materials anders sein als in Stickstoffatmosphäre, was auf die Wirkung der Sauerstoffblockierung zurückzuführen ist. UV-DSC-Tests wurden mit dem Monomer TMPTA unter Luft- und Stickstoffatmosphäre durchgeführt, wenn ein geringerer Initiatorgehalt zugesetzt wurde; die Ergebnisse sind in Tabelle 1 aufgeführt.
| tamaxtamax von TMPTA UV-Härtung mit niedrigem Initiatorgehalt in Luft oder N2 | ||
| Gehalt an Initiator in der Probe/% | tamax/s | |
| Luft | N2 | |
| 0.48 | 2.65 | 2.18 |
| 0.96 | 2.12 | 1.92 |
tamax von TMPTA UV-Härtung mit niedrigem Initiatorgehalt in Luft oder N2
Tabelle 1 zeigt den Vergleich des tamax von TMPTA, das unter Luft bzw. Stickstoff lichtgehärtet wurde, mit dem Zusatz geringerer Mengen an Initiator. Aus der obigen Tabelle ist ersichtlich, dass der Tamax der Lichthärtung unter Luft größer ist als unter Stickstoff, wenn der Initiatorgehalt gleich ist, was darauf hindeutet, dass die Lichthärtung unter Luft durch die Sauerstoffblockierung beeinflusst wird. Es wird allgemein angenommen, dass der im Rohmaterial und auf der Oberfläche gelöste Sauerstoff während des Lichthärtungsprozesses die folgenden Reaktionen durchläuft.
Die erzeugten Peroxidradikale ROO- sind sehr stabil und können keine Polymerisationsreaktionen einleiten. Sauerstoff fängt nicht nur die vom Initiator während des Lichthärtungsprozesses erzeugten Radikale ab, sondern beendet auch die Monomerradikale.
Die Empfindlichkeit der Photohärtung für sauerstoffblockierende Polymerisation variiert für verschiedene Monomere und hängt mit Faktoren wie Monomerfunktionalität, Doppelbindungsaktivität und Struktur zusammen [13]. Um den Einfluss der Monomerstruktur auf die sauerstoffblockierende Aggregation zu untersuchen, wurden zwei verschiedene EO-isierte TMPTAs für UV-DSC-Experimente unter Luft- bzw. Stickstoffbedingungen ausgewählt. Diese homologen Monomere haben alle eine ähnliche Struktur, abgesehen von der Anzahl der EO-Gruppen, so dass das Problem nicht durch die Wahl anderer Monomere mit sehr unterschiedlichen Strukturen verkompliziert wird [13].
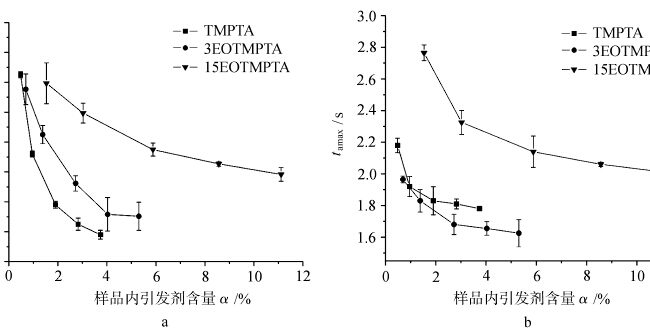
Abbildung 4 zeigt die Variation von Tamax mit dem Initiatorgehalt in der Probe für die Lichthärtung von TMPTA-Monomeren mit verschiedenen EOisationen unter Luft und Stickstoff. Wie aus der Abbildung ersichtlich ist, nimmt das Tamax der einzelnen unter Luft und Stickstoff lichtgehärteten Monomere mit zunehmendem Initiatorgehalt ab. Die Variation des lichtgehärteten Tamax jedes Monomers unter Luft und Stickstoff variiert mit der Menge des EO im Monomer. Dies zeigt, dass der EO-Gehalt im Monomer einen Einfluss auf den Tamax der Lichthärtung hat. Für dasselbe Monomer hängt der Unterschied in der lichtgehärteten Tamax unter Luft und Stickstoff mit der Sauerstoffbarriere zusammen, wenn die anderen Bedingungen gleich sind.
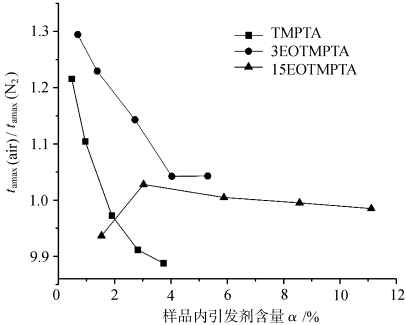
Abbildung 5 zeigt die Kurven des Verhältnisses von tamax jedes Monomers, das unter verschiedenen Atmosphären photogehärtet wurde, mit der Variation des Initiatorgehalts α. tamax(Luft)/tamax(N2) gibt den Unterschied von tamax des Monomers an, das unter Luft und Stickstoff photogehärtet wurde, und spiegelt somit das Ausmaß der Sauerstoffblockierung jedes photogehärteten Monomers wider; je größer der Wert, desto größer der Sauerstoffblockierungseffekt. Wie in Abbildung 5 zu sehen ist, waren die Verhältnisse tamax(Luft)/tamax(N2) des Monomers TMPTA und des Monomers 3EOTMPTA größer, wenn der Initiatorgehalt gering war, und nahmen mit steigendem Initiatorgehalt ab. Dies deutet darauf hin, dass das monomere TMPTA und das monomere 3EOTMPTA bei einem geringen Initiatorgehalt einen stärkeren Sauerstoffblockierungseffekt aufweisen. Wenn die EO-Menge im Monomer 15 erreicht, liegt das Tamax(Luft)/Tamax(N2)-Verhältnis des Monomers nahe bei 1, d. h., Das bedeutet, dass die Erhöhung des EO-Gehalts im Monomer dazu beiträgt, die sauerstoffblockierende Polymerisation der UV-Härtung zu verringern, was mit dem aktiven Wasserstoff in der EO-Struktur zusammenhängen kann. Die etherähnliche Struktur in der EO-Einheit Das α-H an der -O-CH2-Gruppe kann leicht durch Sauerstoff ersetzt werden, und es kommt zu den folgenden Reaktionen.
Das Verhältnis von tamax(Luft)/tamax(N2) mit dem Initiatorgehalt bei der Aushärtung von verschiedenen ethoxylierten TMPTA.
α-H kann einerseits einen Teil des Sauerstoffs im System verbrauchen, andererseits kann es das durch das Radikal und den Sauerstoff erzeugte Peroxidradikal ROO- beenden, wodurch der Verbrauch reaktiver Radikale verringert und die initiierende Aktivität auf das Kettensegment mit initiierender Aktivität umgelenkt wird, wodurch die Sauerstoffblockade des Lichthärtungsprozesses verringert wird.
2.3 Einfluss der Menge an α-H in den Monomeren auf die lichthärtende sauerstoffblockierende Aggregation
Um die Beziehung zwischen der Sauerstoffblockierung und der Menge an α-H in den monomeren EO-Gruppen zu untersuchen, wurden die tamax-α-Kurven in Abbildung 4 an verschiedene Gleichungen linear angepasst, und es wurde festgestellt, dass der höchste Korrelationskoeffizient durch die lineare Anpassung der Gleichung lnt=a+b/α0,5 erzielt wurde. Die aus den Anpassungen erhaltenen Steigungen b und die Korrelationskoeffizienten R sind in Tabelle 2 aufgeführt.
| Der Wert von b und R durch lineare Anpassung 1/α0,5 und lnt | ||||
| Monomer | Luft | N2 | ||
| b | R | b | R | |
| TMPTA | 0.056 | 0.99894 | 0.0213 | 0.95494 |
| EO3TMPTA | 0.0554 | 0.95877 | 0.0257 | 0.98564 |
| 15EOTMPTA | 0.0531 | 0.96578 | 0.062 | 0.98944 |
Vergleicht man die μ-Werte für die verschiedenen Monomere in Abbildung 6, so hat μ einen Maximalwert, wenn das Monomer TMPTA ist, d. h. die sauerstoffblockierende Wirkung ist am größten, wenn das Monomer TMPTA UV-gehärtet ist. Mit zunehmendem EO-Gehalt im Monomer nimmt die Menge an α-H im Monomer zu und der μ-Wert sinkt, was darauf hindeutet, dass die Sauerstoffbarriere mit der Menge an α-H im Monomer zusammenhängt, das den Sauerstoff und die Peroxidradikale im System einfängt und die Sauerstoffbarriere mindert. Die Viskosität ist eine Eigenschaft, die mit der molekularen Struktur zusammenhängt und die Fließeigenschaften des Monomers einbezieht. Daher ist es notwendig, die Auswirkungen der Fließeigenschaften des Monomers auf die Sauerstoffbarrierepolymerisation weiter zu diskutieren.
2.4 Einfluss der Fließeigenschaften von Monomeren auf die Aggregation der Sauerstoffbarriere
Die Fließeigenschaften des Systems hängen mit der Struktur des Moleküls zusammen. Im Allgemeinen gilt: Je flexibler die Molekülkette ist, desto geringer ist die Rotationsbarriere innerhalb der Kette, desto kürzer ist das Kettensegment als mobile Einheit, und je geringer die Aktivierungsenergie der flexiblen Molekülkette ist, desto besser ist die Mobilität. Je größer das Molekulargewicht ist, desto größer ist der innere Reibungswiderstand gegenüber der Molekularbewegung und desto geringer ist die Mobilität [19]. Daher wird die Einführung von EO-Gruppen in das TMPTA-Monomer die Fließeigenschaften des Systems verändern. Mit einem Rheometer mit einer konstanten Scherrate von 19,1/min und einer Temperaturerhöhungsrate von 2 °C/min wurden die Viskositätskurven jedes Monomers in Abhängigkeit von der Temperatur gemessen. Die Viskositäts-Temperatur-Kurven der einzelnen Monomere wurden an die Arrhenius-Gleichung angepasst, und die berechnete Fließaktivierungsenergie E, der Vorfaktor A und die Monomerviskosität η bei 25 ℃ wurden in Tabelle 3 aufgeführt.
| Der Wert der Viskosität η(25 ℃), der Fließaktivierungsenergie E und des präexponentiellen Faktors A der Monomere | |||
| Monomer | η/Pa-s(25℃) | A/10-8 | E/J |
| TMPTA | 0.01934 | 15.53 | 29079.88 |
| 3EOTMPTA | 0.06948 | 2.65 | 36600.47 |
| 15EOTMPTA | 0.18016 | 6.28 | 36821.87 |
Die Fließaktivierungsenergie E hängt mit der Molekülstruktur zusammen und wird durch die Steifigkeit und Flexibilität der Molekülkette, die Größe und Polarität der Seitengruppen usw. beeinflusst. Der Indexfrontfaktor A ist eine Konstante, die mit dem Molekulargewicht zusammenhängt. Um die Beziehung zwischen den Fließeigenschaften von Monomeren und der Sauerstoffbarriere zu untersuchen, wurden die μ-Werte verschiedener Monomere mit den entsprechenden Viskositäten η, der Fließaktivierungsenergie E und dem Vorfaktor A korreliert, wie in Abbildung 7 dargestellt.
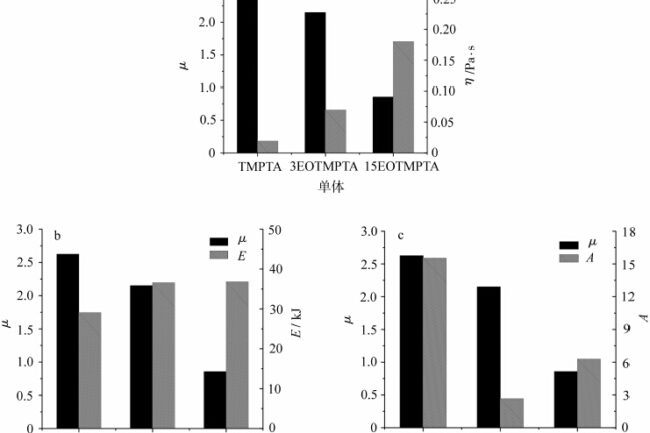
Abbildung 7 zeigt den Vergleich der μ-Werte verschiedener Monomere in Abhängigkeit von der Fließaktivierungsenergie E, dem Fingerfrontfaktor A bzw. der Viskosität η. Wie in Abb. 7a zu sehen ist, nimmt der μ-Wert tendenziell ab, wenn die Anzahl der EO im Monomer steigt und die Viskosität des Monomers zunimmt. Die Größe der sauerstoffblockierenden Aggregation hängt eng mit der Sauerstoffkonzentration zusammen, und je höher die Sauerstoffkonzentration ist, desto deutlicher ist die Sauerstoffblockierung [7]. Im Inneren des lichthärtenden Systems gibt es eine bestimmte Menge an gelöstem Sauerstoff, und die Geschwindigkeit des Löschens und Abfangens freier Radikale durch Sauerstoff im Lichthärtungsprozess ist extrem schnell, und der verbrauchte Sauerstoff wird hauptsächlich durch die Diffusion von Sauerstoff aus der Luft in das Innere des Systems kontinuierlich aufgefüllt, was sicherlich die Fähigkeit der Sauerstoffbewegung im System mit sich bringt, und die Fähigkeit der Sauerstoffbewegung im System hängt mit der Viskosität des Systems zusammen. Wenn die Viskosität des Systems niedrig ist, kann der Luftsauerstoff leichter in das Innere des Systems diffundieren, was eine größere sauerstoffblockierende Wirkung hat, so dass der μ-Wert des Monomers TMPTA höher ist und in erheblichem Maße durch Sauerstoff blockiert wird. Wenn die Viskosität des Systems zunimmt, nimmt die Fähigkeit zur Sauerstoffbewegung im System ab, und es ist zu spät, um den durch das Abfangen freier Radikale verbrauchten Sauerstoff wieder aufzufüllen, und die Sauerstoffblockade nimmt ab. Wie aus der Abbildung ersichtlich ist, steigt die Monomerviskosität weiter an, wenn die EO-Menge im Monomer auf 15 ansteigt, und der μ-Wert tendiert gegen 1, d. h. der Unterschied zwischen der Lichthärtung unter Luft und Stickstoff ist nicht signifikant.
Vergleichen Sie dann die Fließaktivierungsenergie und den Fingerfrontfaktor des Monomers mit dem μ-Wert. Wie in Abbildung 7b zu sehen ist, steigt die Fließaktivierungsenergie des Monomers von TMPTA auf 3EOTMPTA mit der Einführung von EO-Gruppen in das Monomer. Als die Menge der EO im Monomer von 3 auf 15 erhöht wurde, blieb die Fließaktivierungsenergie im Wesentlichen unverändert, was darauf hinweist, dass die Erhöhung der EO-Menge im Monomer im Grunde keine Auswirkungen auf die Fließaktivierungsenergie hat. Denn obwohl die Anzahl der EO im Monomer zunimmt, ändert sich die Anzahl der kinematischen Einheiten nicht, was zeigt, dass die Auswirkung der Fließaktivierungsenergie auf die Sauerstoffbarriere für das EO-isierte TMPTA-Monomer nicht signifikant ist. Wie in Abb. 7c zu sehen ist, ändert sich der Fingerpräfaktor A stark von TMPTA zu 3EOTMPTA, was mit dem Vorhandensein oder Fehlen von EO-Gruppen zusammenhängen kann. Mit zunehmender Anzahl der EO-Gruppen im Monomer steigt der Präfaktor A an, was auf die Zunahme der Anzahl der EO-Gruppen im Monomer zurückzuführen ist, die zu einer Zunahme des Molekulargewichts des Monomers führt. Es kann gezeigt werden, dass bei EO-isierten TMPTA-Monomeren die Zunahme der Anzahl der EO im Molekül zu einer Erhöhung des Molekulargewichts führt, was eine Erhöhung der Viskosität des Monomers zur Folge hat und somit die Sauerstoffbarriere verringert. Bei polymeren Materialien kann die Viskosität des Systems im Allgemeinen durch Erhöhung der Steifigkeit der Molekülkette, Erhöhung der Polarität der Seitengruppen, Erhöhung des Molekulargewichts usw. erhöht werden. Es kann vermutet werden, dass die nachteiligen Auswirkungen der lichthärtenden Sauerstoffsperre durch eine geeignete Formulierungszusammensetzung, wie z. B. die Einführung von Strukturen mit aktivem Wasserstoff, die Erhöhung des Anteils starrer Moleküle und die Erhöhung des Molekulargewichts, verringert werden können.
3 Schlussfolgerung
(1) Eine Erhöhung der Anzahl der EO-Gruppen im Monomermolekül kann die sauerstoffblockierende Aggregation während des Lichthärtungsprozesses verringern. Dies hängt mit dem Einschluss von Sauerstoff und Peroxidradikalen durch das α-H in dieser Gruppe und dem Anstieg der Systemviskosität zusammen.
(2) Bei mehreren für diese Studie ausgewählten EO-haltigen TMPTAs hat die Fließaktivierungsenergie des Monomers kaum Auswirkungen auf die sauerstoffblockierende Aggregation. Die Erhöhung der EO-Menge im Monomer führt zu einer Zunahme des Molekulargewichts, was zu einem Anstieg der Viskosität des Monomers führt, was sich wiederum auf die Sauerstoffbarriereaggregation auswirkt.
UV-Monomer Produkte der gleichen Serie
| Polythiol/Polymercaptan | ||
| DMES Monomer | Bis(2-mercaptoethyl)sulfid | 3570-55-6 |
| DMPT Monomer | THIOCURE DMPT | 131538-00-6 |
| PETMP-Monomer | 7575-23-7 | |
| PM839 Monomer | Polyoxy(methyl-1,2-ethandiyl) | 72244-98-5 |
| Monofunktionelles Monomer | ||
| HEMA-Monomer | 2-Hydroxyethylmethacrylat | 868-77-9 |
| HPMA-Monomer | 2-Hydroxypropylmethacrylat | 27813-02-1 |
| THFA-Monomer | Tetrahydrofurfurylacrylat | 2399-48-6 |
| HDCPA Monomer | Hydriertes Dicyclopentenylacrylat | 79637-74-4 |
| DCPMA-Monomer | Dihydrodicyclopentadienylmethacrylat | 30798-39-1 |
| DCPA Monomer | Dihydrodicyclopentadienyl-Acrylat | 12542-30-2 |
| DCPEMA-Monomer | Dicyclopentenyloxyethylmethacrylat | 68586-19-6 |
| DCPEOA-Monomer | Dicyclopentenyloxyethylacrylat | 65983-31-5 |
| NP-4EA Monomer | (4) ethoxyliertes Nonylphenol | 50974-47-5 |
| LA Monomer | Laurylacrylat / Dodecylacrylat | 2156-97-0 |
| THFMA Monomer | Tetrahydrofurfurylmethacrylat | 2455-24-5 |
| PHEA-Monomer | 2-PHENOXYETHYLACRYLAT | 48145-04-6 |
| LMA Monomer | Laurylmethacrylat | 142-90-5 |
| IDA Monomer | Isodecylacrylat | 1330-61-6 |
| IBOMA Monomer | Isobornylmethacrylat | 7534-94-3 |
| IBOA Monomer | Isobornylacrylat | 5888-33-5 |
| EOEOEA Monomer | 2-(2-Ethoxyethoxy)ethylacrylat | 7328-17-8 |
| Multifunktionelles Monomer | ||
| DPHA Monomer | 29570-58-9 | |
| DI-TMPTA Monomer | DI(TRIMETHYLOLPROPAN)TETRAACRYLAT | 94108-97-1 |
| Acrylamid-Monomer | ||
| ACMO Monomer | 4-Acryloylmorpholin | 5117-12-4 |
| Difunktionelles Monomer | ||
| PEGDMA-Monomer | Poly(ethylenglykol)dimethacrylat | 25852-47-5 |
| TPGDA Monomer | Tripropylenglykol-Diacrylat | 42978-66-5 |
| TEGDMA-Monomer | Triethylenglykol-Dimethacrylat | 109-16-0 |
| PO2-NPGDA Monomer | Propoxylat-Neopentylenglykol-Diacrylat | 84170-74-1 |
| PEGDA-Monomer | Polyethylenglykol-Diacrylat | 26570-48-9 |
| PDDA-Monomer | Phthalat Diethylenglykol-Diacrylat | |
| NPGDA Monomer | Neopentylglykol-Diacrylat | 2223-82-7 |
| HDDA-Monomer | Hexamethylen-Diacrylat | 13048-33-4 |
| EO4-BPADA Monomer | ETHOXYLIERTES (4) BISPHENOL-A-DIACRYLAT | 64401-02-1 |
| EO10-BPADA Monomer | ETHOXYLIERTES (10) BISPHENOL-A-DIACRYLAT | 64401-02-1 |
| EGDMA Monomer | Ethylenglykol-Dimethacrylat | 97-90-5 |
| DPGDA-Monomer | Dipropylenglykol-Dienoat | 57472-68-1 |
| Bis-GMA-Monomer | Bisphenol A Glycidylmethacrylat | 1565-94-2 |
| Trifunktionelles Monomer | ||
| TMPTMA Monomer | Trimethylolpropantrimethacrylat | 3290-92-4 |
| TMPTA-Monomer | Trimethylolpropantriacrylat | 15625-89-5 |
| PETA Monomer | 3524-68-3 | |
| GPTA ( G3POTA ) Monomer | GLYCERIN-PROPOXYTRIACRYLAT | 52408-84-1 |
| EO3-TMPTA Monomer | Ethoxyliertes Trimethylolpropantriacrylat | 28961-43-5 |
| Photoresist Monomer | ||
| IPAMA-Monomer | 2-Isopropyl-2-adamantylmethacrylat | 297156-50-4 |
| ECPMA Monomer | 1-Ethylcyclopentylmethacrylat | 266308-58-1 |
| ADAMA Monomer | 1-Adamantylmethacrylat | 16887-36-8 |
| Methacrylat-Monomer | ||
| TBAEMA Monomer | 2-(Tert-Butylamino)ethylmethacrylat | 3775-90-4 |
| NBMA Monomer | n-Butylmethacrylat | 97-88-1 |
| MEMA Monomer | 2-Methoxyethylmethacrylat | 6976-93-8 |
| i-BMA Monomer | Isobutylmethacrylat | 97-86-9 |
| EHMA Monomer | 2-Ethylhexylmethacrylat | 688-84-6 |
| EGDMP-Monomer | Ethylenglykol-Bis(3-mercaptopropionat) | 22504-50-3 |
| EEMA Monomer | 2-Ethoxyethyl-2-methylprop-2-enoat | 2370-63-0 |
| DMAEMA Monomer | N,M-Dimethylaminoethylmethacrylat | 2867-47-2 |
| DEAM Monomer | Diethylaminoethylmethacrylat | 105-16-8 |
| CHMA Monomer | Cyclohexylmethacrylat | 101-43-9 |
| BZMA-Monomer | Benzylmethacrylat | 2495-37-6 |
| BDDMP-Monomer | 1,4-Butandiol Di(3-mercaptopropionat) | 92140-97-1 |
| BDDMA-Monomer | 1,4-Butandioldimethacrylat | 2082-81-7 |
| AMA Monomer | Allylmethacrylat | 96-05-9 |
| AAEM Monomer | Acetylacetoxyethylmethacrylat | 21282-97-3 |
| Acrylate Monomer | ||
| IBA Monomer | Isobutyl-Acrylat | 106-63-8 |
| EMA-Monomer | Ethylmethacrylat | 97-63-2 |
| DMAEA Monomer | Dimethylaminoethylacrylat | 2439-35-2 |
| DEAEA Monomer | 2-(Diethylamino)ethylprop-2-enoat | 2426-54-2 |
| CHA Monomer | Cyclohexylprop-2-enoat | 3066-71-5 |
| BZA Monomer | Benzylprop-2-enoat | 2495-35-4 |