Visão geral dos métodos de imobilização de enzimas
No artigo anterior, mencionamos que as substâncias amargas das frutas cítricas são principalmente a naringina, que pode ser gradualmente decomposta em glicose e naringenina pela naringinase e, por fim, atingir o objetivo de desamargurar. No processo real de produção e uso, em comparação com as enzimas livres, as enzimas imobilizadas não só têm maior eficiência catalítica e melhor especificidade, mas também aumentam a resistência a condições adversas e prolongam a vida útil das enzimas; ao mesmo tempo, é conveniente separar as enzimas imobilizadas do produto da reação, simplificar o processo de produção e reduzir o custo. Portanto, aqui está uma breve introdução aos métodos de imobilização de enzimas comuns.
A enzima imobilizada refere-se a uma enzima que é fixada em um determinado transportador para formar insolubilidade em água e ainda tem propriedades catalíticas. Já em 1954, Glubhofer e Schleith usaram o método diazo para modificar a resina de poliestireno para a imobilização de pepsina e carboxipeptidase para preparar enzimas imobilizadas. Depois, em 1969, o cientista japonês Chi Yanichiro usou aminoácido acilado imobilizado para realizar a produção contínua de L-aminoácido pela primeira vez, o que promoveu o rápido desenvolvimento da tecnologia de imobilização na engenharia de enzimas. Quando as enzimas imobilizadas apareceram, havia muitos nomes diferentes, mas na primeira Conferência Internacional de Engenharia de Enzimas, em 1971, foi formalmente proposto o uso de "enzimas imobilizadas" como um termo adequado. A reação catalisada por enzima tem condições brandas, alta eficiência catalítica e alta especificidade. Ao mesmo tempo, a enzima é fácil de ser degradada e não agride o meio ambiente. A enzima imobilizada não só mantém essas características da enzima, mas também tem muitas propriedades que dificilmente as enzimas livres possuem, tais como ① fácil de separar do sistema de reação; ② reciclável para reciclagem; ③ melhora a estabilidade da enzima sob condições adversas; ④ pode realizar a catálise enzimática em fase não aquosa; ⑤ pode produzir um sistema multienzimático com reação contínua. Como as enzimas imobilizadas podem ter um valor de aplicação importante nas áreas de medicina, alimentos, proteção ambiental etc., elas têm atraído a atenção de estudiosos nos últimos anos e têm muitas aplicações no setor.
Os métodos comuns de imobilização de enzimas incluem principalmente o método de adsorção, o método de incorporação, o método de ligação cruzada e o método de acoplamento covalente. Os dois primeiros pertencem ao método físico, e os dois últimos, ao método químico. O princípio desses métodos para imobilizar a enzima é mostrado na Figura 1.
Figura 1 Método de imobilização da enzima
1 Método de adsorção
O método de adsorção é um método para concluir a imobilização por meio da adsorção da superfície do transportador à enzima ou por meio da interação de carga positiva e negativa entre o transportador e a enzima, incluindo adsorção física e adsorção de íons.
-
adsorção física
O método de adsorção física é um método de fixação da enzima na superfície do transportador usando o efeito de adsorção do transportador na enzima. O método é simples de operar, não requer modificação e ativação, e o centro ativo da enzima é bem preservado, mas a força de ligação é baixa, e sua força é principalmente a força intermolecular e a tensão superficial. Os adsorventes comumente usados para imobilização de enzimas incluem carbono ativado, grafeno, terra diatomácea e outros adsorventes não solúveis em água com forte capacidade de absorção de água. Zhao et al. usaram óxido de grafeno reduzido como transportador para co-imobilizar a glicose oxidase e a glucoamilase para preparar uma enzima composta imobilizada.
-
adsorção de íons
O método de adsorção de íons é um método de imobilização da enzima por meio da interação de carga positiva e negativa entre o transportador e a enzima. O método tem condições de preparação suaves, e a atividade da enzima não é fácil de perder, mas a força de ligação também é fraca e fácil de cair. Mateo et al. prepararam um novo tipo de resina de troca iônica para fixar lipase, β-galactosidase e aminoácido oxidase, respectivamente. Sob as condições de pH 7,0 e 4 ℃, a enzima pode atingir a saturação de adsorção em poucos minutos, e a taxa de recuperação da atividade enzimática chega a 100%, mostrando um bom efeito de imobilização.
2 Método de incorporação
O método de incorporação é um método no qual a enzima é incorporada em um material poroso, e inclui o método de incorporação em gel e o método de incorporação em membrana semipermeável. O método de incorporação em gel é um método de fixação no qual a enzima é incorporada na estrutura da rede interna do gel (Figura 1B-a). Zhang Shuxiang e outros usaram alginato de sódio para incorporar lacase fúngica para tratar águas residuais de fabricação de papel de baixa concentração. A taxa máxima de recuperação da atividade enzimática foi de 48%, e a atividade enzimática permaneceu em 64% após 8 execuções. O método de incorporação de membrana semipermeável é um método de imobilização de enzimas em uma membrana semipermeável feita de polímeros de alto peso molecular (Figura 1B-b). Esse método também não requer modificação química e não afeta a atividade da enzima, mas não é fácil controlar o tamanho da membrana. É difícil manter a atividade da enzima e, ao mesmo tempo, controlar a livre entrada e saída de reagentes e produtos sem vazamento da enzima. Portanto, esse método geralmente é combinado com outros métodos em uso prático. Rilling P et al. usaram um transportador para imobilizar moléculas de proteína em uma microcápsula, o que não só aumentou a estabilidade da enzima imobilizada, mas também melhorou suas propriedades.
3 Método de ligação cruzada
O método de reticulação é um método no qual as moléculas de enzima são reticuladas umas com as outras usando reagentes bifuncionais ou multifuncionais, e as moléculas de enzima e os reagentes formam uma ligação covalente e são fixados. A enzima imobilizada preparada por esse método tem boa estabilidade, mas alguns grupos da enzima, como amino, sulfidrila, imidazolil etc., podem participar da reação de ligação cruzada. Se o agente de reticulação e o grupo funcional selecionados não forem apropriados, a estrutura do centro ativo da enzima poderá ser destruída, resultando em uma séria perda da atividade da enzima, de modo que esse método geralmente é combinado com outros métodos. Li Xiaojing e outros primeiro encapsularam a pepsina com solução de alginato de sódio e, em seguida, adicionaram gota a gota a uma solução contendo uma determinada concentração de quitosana e CaCl2 para obter microesferas de enzima imobilizadas e, em seguida, adicionou uma certa quantidade de glutaraldeído para a ligação cruzada para obter pepsina imobilizada. Esse método obteve uma enzima imobilizada com boa estabilidade operacional e estabilidade térmica.
4 Método de acoplamento covalente
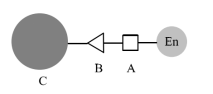
O método de acoplamento covalente (também conhecido como método de ligação covalente) é um método de imobilização da enzima por meio da formação de uma ligação covalente entre a enzima e o transportador (conforme mostrado na Figura 2).
Figura 2 Enzima imobilizada pelo método de ligação covalente, A - resíduo de aminoácido ativo; B - grupo de ligação no transportador; C - transportador.
Os métodos de ligação covalente geralmente incluem três tipos: (1) o transportador é modificado e ativado e, em seguida, ligado covalentemente à molécula da enzima; (2) o transportador e a molécula da enzima são ligados covalentemente por meio de um agente de acoplamento; (3) a molécula da enzima é modificada após a ativação e combinada com o transportador. Entre eles, o primeiro tipo é mais comumente usado. Após a ativação do transportador para conectar determinados grupos ativos, como amino, epóxi etc., ao resíduo ativo da molécula da enzima (como amino, carboxila, hidroxila etc.), a enzima é imobilizada. Esse método é muito mais confiável do que o método de adsorção. Ao mesmo tempo, como o transportador é geralmente maior, os resíduos de aminoácidos envolvidos na reação da enzima são geralmente aqueles expostos na periferia da enzima, e o efeito no centro ativo da enzima é relativamente pequeno. Esse é um excelente método de imobilização de enzimas. Yan Keliang e outros usaram nanopartículas magnéticas aminosilanizadas para imobilizar a pectinase, e a taxa de imobilização e a taxa de recuperação da atividade enzimática foram de 44,44% e 40,86%, respectivamente, obtendo um bom efeito de imobilização. O próximo artigo continuará a apresentar em detalhes os diferentes métodos de preparação de microesferas magnéticas de biopolímero.
Entre em contato conosco agora!
Se precisar do Price, preencha suas informações de contato no formulário abaixo. Normalmente, entraremos em contato dentro de 24 horas. Você também pode me enviar um e-mail info@longchangchemical.com durante o horário comercial (das 8h30 às 18h UTC+8 de segunda a sábado) ou use o bate-papo ao vivo do site para obter uma resposta imediata.
| Composto Glucoamilase | 9032-08-0 |
| Pullulanase | 9075-68-7 |
| Xilanase | 37278-89-0 |
| Celulase | 9012-54-8 |
| Naringinase | 9068-31-9 |
| β-Amilase | 9000-91-3 |
| Glucose oxidase | 9001-37-0 |
| alfa-Amilase | 9000-90-2 |
| Pectinase | 9032-75-1 |
| Peroxidase | 9003-99-0 |
| Lipase | 9001-62-1 |
| Catalase | 9001-05-2 |
| TANNASE | 9025-71-2 |
| Elastase | 39445-21-1 |
| Urease | 9002-13-5 |
| DEXTRANASE | 9025-70-1 |
| L-Láctico desidrogenase | 9001-60-9 |
| Malato desidrogenase | 9001-64-3 |
| Colesterol oxidase | 9028-76-6 |