Überblick über Enzym-Immobilisierungsmethoden
Im vorangegangenen Artikel haben wir erwähnt, dass die Bitterstoffe in Zitrusfrüchten hauptsächlich aus Naringin bestehen, das durch Naringinase schrittweise in Glukose und Naringenin zerlegt werden kann, um schließlich den Zweck der Entbitterung zu erreichen. Im tatsächlichen Produktions- und Anwendungsprozess haben immobilisierte Enzyme im Vergleich zu freien Enzymen nicht nur eine höhere katalytische Effizienz und eine bessere Spezifität, sondern sie sind auch widerstandsfähiger gegen raue Bedingungen und verlängern die Lebensdauer der Enzyme; gleichzeitig lassen sich immobilisierte Enzyme leicht vom Reaktionsprodukt trennen, was den Produktionsprozess vereinfacht und die Kosten reduziert. Daher wird hier eine kurze Einführung in die Immobilisierungsmethoden für gängige Enzyme gegeben.
Als immobilisiertes Enzym bezeichnet man ein Enzym, das auf einem bestimmten Träger fixiert ist, so dass es wasserunlöslich ist und dennoch katalytische Eigenschaften besitzt. Bereits 1954 verwendeten Glubhofer und Schleith die Diazomethode, um Polystyrolharz für die Immobilisierung von Pepsin und Carboxypeptidase zu modifizieren und immobilisierte Enzyme herzustellen. Im Jahr 1969 verwendete der japanische Wissenschaftler Chi Yanichiro immobilisierte acylierte Aminosäure, um erstmals eine kontinuierliche Produktion von L-Aminosäure zu realisieren, was die rasche Entwicklung der Immobilisierungstechnologie in der Enzymtechnik vorantrieb. Als immobilisierte Enzyme aufkamen, gab es viele verschiedene Bezeichnungen, aber auf der ersten Internationalen Enzymtechnik-Konferenz 1971 wurde offiziell vorgeschlagen, "immobilisierte Enzyme" als richtigen Begriff zu verwenden. Die enzymkatalysierte Reaktion erfolgt unter milden Bedingungen, mit hoher katalytischer Effizienz und hoher Spezifität. Zugleich ist das Enzym leicht abbaubar und umweltfreundlich. Das immobilisierte Enzym behält nicht nur diese Eigenschaften des Enzyms, sondern verfügt auch über viele Eigenschaften, die freie Enzyme nur schwer aufweisen können, wie z. B: ① leicht vom Reaktionssystem zu trennen; ② recycelbar für das Recycling; ③ Verbesserung der Stabilität des Enzyms unter rauen Bedingungen; ④ Es kann Enzymkatalyse in nichtwässriger Phase realisieren; ⑤ Es kann ein Multienzym-System mit kontinuierlicher Reaktion erzeugen. Da immobilisierte Enzyme in den Bereichen Medizin, Lebensmittel, Umweltschutz usw. von großem Nutzen sein können, haben sie in den letzten Jahren die Aufmerksamkeit von Wissenschaftlern auf sich gezogen und finden in der Industrie zahlreiche Anwendungen.
Zu den gängigen Methoden der Enzymimmobilisierung gehören vor allem die Adsorptionsmethode, die Einbettungsmethode, die Vernetzungsmethode und die kovalente Kopplungsmethode. Die ersten beiden gehören zu den physikalischen Methoden, die letzten beiden zu den chemischen Methoden. Das Prinzip dieser Methoden zur Immobilisierung von Enzymen ist in Abbildung 1 dargestellt.

Abbildung 1 Verfahren zur Immobilisierung des Enzyms
1 Adsorptionsverfahren
Die Adsorptionsmethode ist eine Methode zur vollständigen Immobilisierung durch die Oberflächenadsorption des Trägers an das Enzym oder durch die Wechselwirkung zwischen positiver und negativer Ladung zwischen dem Träger und dem Enzym, einschließlich physikalischer Adsorption und Ionenadsorption.
-
physikalische Adsorption
Die physikalische Adsorptionsmethode ist eine Methode zur Fixierung des Enzyms auf der Oberfläche des Trägers unter Ausnutzung der Adsorptionswirkung des Trägers auf das Enzym. Die Methode ist einfach zu handhaben, erfordert keine Modifizierung und Aktivierung, und das aktive Zentrum des Enzyms bleibt gut erhalten, aber die Bindungskraft ist gering, und ihre Kraft ist hauptsächlich intermolekulare Kraft und Oberflächenspannung. Zu den Adsorbentien, die üblicherweise für die Immobilisierung von Enzymen verwendet werden, gehören Aktivkohle, Graphen, Diatomeenerde und andere nicht wasserlösliche Adsorbentien mit starker Wasseraufnahmekapazität. Zhao et al. verwendeten reduziertes Graphenoxid als Träger, um Glukoseoxidase und Glucoamylase gemeinsam zu immobilisieren und ein immobilisiertes Enzymkomposit herzustellen.
-
Ionenadsorption
Die Ionenadsorptionsmethode ist eine Methode zur Immobilisierung des Enzyms durch die Wechselwirkung zwischen positiver und negativer Ladung des Trägers und des Enzyms. Die Methode hat milde Präparationsbedingungen, und die Enzymaktivität ist nicht leicht zu verlieren, aber die Bindungskraft ist auch schwach und kann leicht abfallen. Mateo et al. stellten eine neue Art von Ionenaustauscherharz her, um Lipase, β-Galactosidase bzw. Aminosäureoxidase zu fixieren. Unter den Bedingungen von pH 7,0 und 4 ℃ kann das Enzym die Adsorptionssättigung innerhalb weniger Minuten erreichen, und die Wiederherstellungsrate der Enzymaktivität beträgt bis zu 100%, was eine gute Immobilisierungswirkung zeigt.
2 Einbettungsmethode
Die Einbettungsmethode ist eine Methode, bei der das Enzym in ein poröses Material eingebettet wird, und umfasst die Geleinbettungsmethode und die halbdurchlässige Membraneinbettungsmethode. Bei der Geleinbettungsmethode handelt es sich um eine Fixierungsmethode, bei der das Enzym in die interne Netzwerkstruktur des Gels eingebettet wird (Abbildung 1B-a). Zhang Shuxiang und andere verwendeten Natriumalginat zur Einbettung von Pilzlaccase, um Abwässer aus der Papierherstellung mit geringer Konzentration zu behandeln. Die maximale Rückgewinnungsrate der Enzymaktivität betrug 48%, und die Enzymaktivität blieb nach 8 Durchläufen bei 64%. Die Methode der semipermeablen Membraneinbettung ist eine Methode zur Immobilisierung von Enzymen in einer semipermeablen Membran aus hochmolekularen Polymeren (Abbildung 1B-b). Diese Methode erfordert ebenfalls keine chemische Modifikation und beeinträchtigt die Aktivität des Enzyms nicht, aber es ist nicht einfach, die Größe der Membran zu kontrollieren. Es ist schwierig, die Enzymaktivität aufrechtzuerhalten und gleichzeitig den freien Ein- und Austritt von Reaktanten und Produkten zu kontrollieren, ohne dass das Enzym ausläuft. Daher wird diese Methode in der Praxis meist mit anderen Methoden kombiniert. Rilling P et al. verwendeten einen Träger, um Proteinmoleküle gemeinsam in einer Mikrokapsel zu immobilisieren, was nicht nur die Stabilität des immobilisierten Enzyms erhöhte, sondern auch seine Eigenschaften verbesserte.
3 Vernetzungsmethode
Die Vernetzungsmethode ist eine Methode, bei der die Enzymmoleküle mit Hilfe bifunktioneller oder multifunktioneller Reagenzien miteinander vernetzt werden und die Enzymmoleküle und die Reagenzien eine kovalente Bindung eingehen und fixiert werden. Das mit dieser Methode hergestellte immobilisierte Enzym hat eine gute Stabilität, aber einige Gruppen des Enzyms wie Amino, Sulfhydryl, Imidazolyl usw. können an der Vernetzungsreaktion teilnehmen. Wenn das gewählte Vernetzungsmittel und die funktionelle Gruppe nicht geeignet sind, kann die Struktur des aktiven Zentrums des Enzyms zerstört werden, was zu einem schwerwiegenden Verlust der Enzymaktivität führt, weshalb diese Methode in der Regel mit anderen Methoden kombiniert wird. Li Xiaojing und andere verkapselten Pepsin zunächst mit einer Natriumalginatlösung und fügten es dann tropfenweise zu einer Lösung hinzu, die eine bestimmte Konzentration von Chitosan und CaCl2 um immobilisierte Enzym-Mikrosphären zu erhalten, und fügte dann eine bestimmte Menge Glutaraldehyd zur Vernetzung hinzu, um immobilisiertes Pepsin zu erhalten. Mit dieser Methode wurde ein immobilisiertes Enzym mit guter Betriebs- und Wärmestabilität erhalten.
4 Kovalente Kopplungsmethode
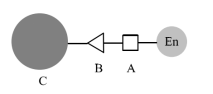
Die kovalente Kopplungsmethode (auch als kovalente Bindungsmethode bekannt) ist eine Methode zur Immobilisierung des Enzyms durch Bildung einer kovalenten Bindung zwischen dem Enzym und dem Träger (siehe Abbildung 2).
Abbildung 2 Immobilisiertes Enzym durch kovalente Bindungsmethode, A-aktiver Aminosäurerest; B-Bindungsgruppe auf Träger; C-Träger.
Kovalente Bindungsmethoden umfassen im Allgemeinen drei Arten: (1) der Träger wird modifiziert und aktiviert und dann kovalent an das Enzymmolekül gebunden; (2) der Träger und das Enzymmolekül werden durch ein Kopplungsmittel kovalent gebunden; (3) das Enzymmolekül wird nach der Aktivierung modifiziert und mit dem Träger kombiniert. Der erste Typ wird am häufigsten verwendet. Nach Aktivierung des Trägers, um bestimmte aktive Gruppen wie Amino, Epoxy usw. mit dem aktiven Rest des Enzymmoleküls (wie Amino, Carboxyl, Hydroxyl usw.) zu verbinden, wird das Enzym immobilisiert. Diese Methode ist viel zuverlässiger als die Adsorptionsmethode. Da der Träger in der Regel größer ist, sind die Aminosäurereste, die an der Reaktion auf dem Enzym beteiligt sind, im Allgemeinen an der Peripherie des Enzyms exponiert, und die Auswirkungen auf das aktive Zentrum des Enzyms sind relativ gering. Dies ist eine ausgezeichnete Methode, um Enzyme zu immobilisieren. Yan Keliang und andere verwendeten aminosilanisierte magnetische Nanopartikel, um Pektinase zu immobilisieren, und die Immobilisierungsrate und die Wiedergewinnungsrate der Enzymaktivität betrugen 44,44% bzw. 40,86%, wodurch ein guter Immobilisierungseffekt erzielt wurde. Im nächsten Artikel werden wir die verschiedenen Methoden zur Herstellung von magnetischen Biopolymer-Mikrokugeln im Detail vorstellen.
Kontaktieren Sie uns jetzt!
Wenn Sie einen Preis benötigen, tragen Sie bitte Ihre Kontaktdaten in das unten stehende Formular ein. Wir werden uns in der Regel innerhalb von 24 Stunden mit Ihnen in Verbindung setzen. Sie können mir auch mailen info@longchangchemical.com während der Geschäftszeiten ( 8:30 bis 18:00 Uhr UTC+8 Mo.~Sa. ) oder nutzen Sie den Live-Chat auf der Website, um eine schnelle Antwort zu erhalten.
| Verbindung Glucoamylase | 9032-08-0 |
| Pullulanase | 9075-68-7 |
| Xylanase | 37278-89-0 |
| Cellulase | 9012-54-8 |
| Naringinase | 9068-31-9 |
| β-Amylase | 9000-91-3 |
| Glukose-Oxidase | 9001-37-0 |
| alpha-Amylase | 9000-90-2 |
| Pektinase | 9032-75-1 |
| Peroxidase | 9003-99-0 |
| Lipase | 9001-62-1 |
| Katalase | 9001-05-2 |
| TANNASE | 9025-71-2 |
| Elastase | 39445-21-1 |
| Urease | 9002-13-5 |
| DEXTRANASE | 9025-70-1 |
| L-Milch-Dehydrogenase | 9001-60-9 |
| Dehydrogenase Malat | 9001-64-3 |
| Cholesterin-Oxidase | 9028-76-6 |