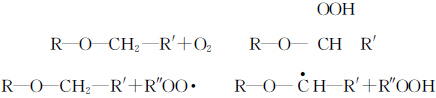Wat is het effect van UV-monomeer op UV-uithardende zuurstofblokkering?
1.2 Monstervoorbereiding en testen
Het monomeer en de initiator werden nauwkeurig afgewogen, waarbij het monomeer niet werd gezuiverd, en gelijkmatig gemengd met een magneetroerder. UV-DSC werd gebruikt om UV-uithardingsexperimenten uit te voeren onder statische luchtatmosfeer en stikstofatmosfeer, en de monsters werden telkens in gelijke hoeveelheden genomen zodat de dikte van de monsters in de kroes gelijk was. Het UV-DSC-programma werd ingesteld om de monstertemperatuur constant te houden gedurende 2 minuten, daarna werd de lichtbron automatisch ingeschakeld door het programma, en het UV-licht (golflengtebereik 325-400 nm) werd in de DSC-cel gebracht door de glasvezel om de staalkroes en de referentiekroes te verlichten, en de DSC mat de warmtestroomwaarde van het fotokhardingsproces van het monster. De lichtintensiteit werd gemeten als 48,27 mW-cm-2. De lichtintensiteit werd bepaald door roet op de bodem van de proefkroes te strooien en de door het licht geabsorbeerde energie werd gemeten door UV-DSC en gedeeld door het oppervlak van de bodem van de proefkroes om de lichtintensiteit te verkrijgen.
2 Resultaten en discussie
2.1 Gegevensverwerking
De lichtuithardingssnelheid werd berekend als
De lichtuithardingssnelheid R=dC/dt=(dH/dt)/Hmax, waarbij dH/dt de warmtestroomwaarde is op de curve van enthalpie versus tijd van het lichtuithardingsproces gemeten met UV-DSC; Hmax is de totale polymerisatiewarmte van het monster bij 200 s blootstelling aan licht, verkregen door integratie van de exotherme lichtuithardingspiek. De tijd die overeenkomt met de maximale uithardingssnelheid van het lichtuithardingsproces is tmax. Vrije radicalen polymerisatie zal automatisch optreden versnelde fenomeen, het licht uithardingssnelheid curve om de tijd afgeleide, de maximale waarde van de curve die overeenkomt met de tijd opgenomen als tamax, kan deze tijd worden beschouwd als de snelst groeiende tijd van licht uithardingssnelheid, op dit moment het systeem zuurstof blokkeren en kooi-effect en andere factoren op het verbruik van primaire radicalen tot een minimum. De vrije radicale initiërende monomeer begint snel te polymeriseren.
Berekening van het initiatorgehalte (molaire fractie) α in het monster:
Waarbij n initiator de molaire hoeveelheid initiator in het systeem is, f de functionele graad van monomeer, en n monomeer de molaire hoeveelheid monomeer in het systeem is. Figuur 1 toont de moleculaire structuur van de initiator Irgacure-184, die een splitsingstype is, en de "2" in de formule (1) betekent dat één molecuul van de initiator theoretisch kan worden ontleed in twee moleculen radicalen door blootstelling aan licht.
De structuurformule van Irgacure-184
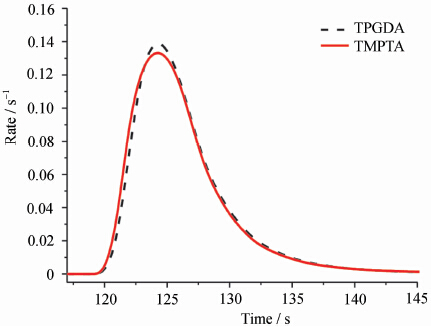
Figuur 2 toont de snelheidscurven van verschillende monomeren lichtuitharding bij 4% initiator inhoud (massafractie). Zoals te zien is in de figuur, zijn er voor verschillende monomeren verschillen in de uithardingssnelheid in de vooruithardingsperiode en dit verschil wordt ook uitgedrukt in de tijd, wat aangeeft dat verschillende monomeren UV-uitharding in de tijd verschillen in snelheid. Het tijdstip tamax wanneer de lichtuithardingssnelheid van het monomeer het snelst toeneemt en het tijdstip tmax dat overeenkomt met de maximale lichtuithardingssnelheid worden vergeleken met de variatiecurve van het initiatorgehalte en de resultaten worden getoond in figuur 3.
UV-uithardingssnelheidscurves van verschillende monomeren met 4% initiator
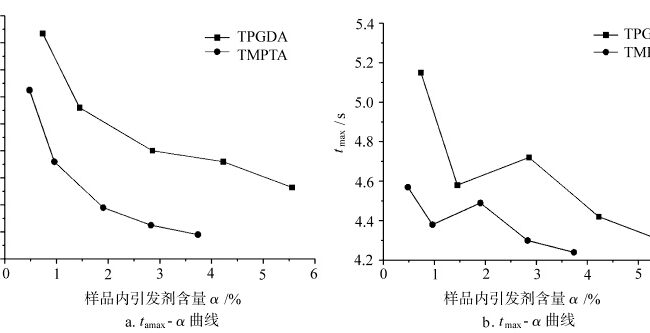
De relatie van tamax en tmax met initiatorgehaltes in uithardingsproces in lucht van verschillende monomeren
Figuur 3 toont de curven van tmax en tamax voor lichtuitharding van verschillende monomeren onder lucht als functie van het initiatorgehalte α in het monster. In het beginstadium van uitharding, wanneer er zuurstof aanwezig is, wordt een deel van de reactieve radicalen die door de fotoinitiator door licht worden gegenereerd, verbruikt door de zuurstof die in het monster is opgelost, en het andere deel initieert monomeerpolymerisatie. Het zuurstofblokkerend effect verbruikt de radicalen die worden gegenereerd door de ontleding van de initiator en de monomeerradicalen, waardoor de tamax en tmax van lichtuitharding worden beïnvloed, wat op zijn beurt de gevoeligheid van lichtuitharding voor zuurstof en initiatorgehalte weergeeft. Zoals te zien is in Fig. 3a neemt de tamax van elke monomeer lichtuitharding af met de toename van het initiatorgehalte in een bepaald patroon. In Fig. 3b vertoont de tmax van elke monomeer lichtuitharding een zekere fluctuatie met de toename van het initiatorgehalte. Dit komt omdat wanneer de uithardingsreactiesnelheid zijn maximum bereikt, het systeem een hoge uithardingsgraad heeft bereikt en de moleculaire ketensegmenten geleidelijk bevroren worden door het glazige effect en de gevoeligheid van de tmax van de lichtuithardingsreactie voor het initiatorgehalte op dit moment afneemt. Terwijl tamax in het beginstadium van lichte uitharding, wanneer het systeem niet hoge graad van uitharding, lichte uitharding reactie is gevoeliger voor de inhoud van de initiator in het systeem. Daarom, in vergelijking, tamax beter weerspiegelt de gevoeligheid van lichte uitharding aan initiator inhoud.
2.2 Effect van de atmosfeer op de lichtuithardende tamax van verschillende monomeren
In luchtatmosfeer zou de tamax van het gefotocuurde materiaal anders moeten zijn dan in stikstofatmosfeer vanwege het effect van zuurstofblokkering. Er werden UV-DSC-tests uitgevoerd op monomeer TMPTA onder lucht- en stikstofatmosfeer bij toevoeging van een lager initiatorgehalte en de resultaten staan vermeld in tabel 1.
| tamaxtamax van TMPTA UV-uitharding met laag initiatorgehalte in lucht of N2 | ||
| Hoeveelheid initiator in het monster/% | tamax/s | |
| lucht | N2 | |
| 0.48 | 2.65 | 2.18 |
| 0.96 | 2.12 | 1.92 |
tamax van TMPTA UV-uitharding met laag initiatorgehalte in lucht of N2
Tabel 1 toont de vergelijking van de tamax van TMPTA gefotocured onder respectievelijk lucht en stikstof met de toevoeging van lagere initiatorgehaltes. Uit de bovenstaande tabel blijkt dat de tamax van lichtuitharding onder lucht groter is dan die onder stikstof wanneer het initiatorgehalte gelijk is, wat aangeeft dat lichtuitharding onder lucht wordt beïnvloed door zuurstofblokkering. Algemeen wordt aangenomen dat de zuurstof opgelost in de grondstof en op het oppervlak de volgende reacties ondergaat tijdens het lichtuithardingsproces.
De gegenereerde peroxideradicalen ROO- zijn zeer stabiel en kunnen geen polymerisatiereacties starten. Zuurstof ruimt niet alleen de radicalen op die tijdens het lichtuithardingsproces door de initiator worden gegenereerd, maar beëindigt ook de monomeerradicalen.
De gevoeligheid van fotokuren voor zuurstofblokkerende polymerisatie varieert voor verschillende monomeren en is gerelateerd aan factoren zoals monomeerfunctionaliteit, dubbelebindingsactiviteit en structuur [13]. Om het effect van de monomeerstructuur op zuurstofblokkerende aggregatie te onderzoeken, werden twee verschillende TMPTA's met EO geselecteerd voor UV-DSC-experimenten onder respectievelijk lucht- en stikstofcondities. Deze homologe monomeren hebben allemaal een vergelijkbare structuur, met uitzondering van het aantal EO-groepen, waardoor het probleem niet gecompliceerd wordt door andere monomeren te kiezen met sterk verschillende structuren [13].
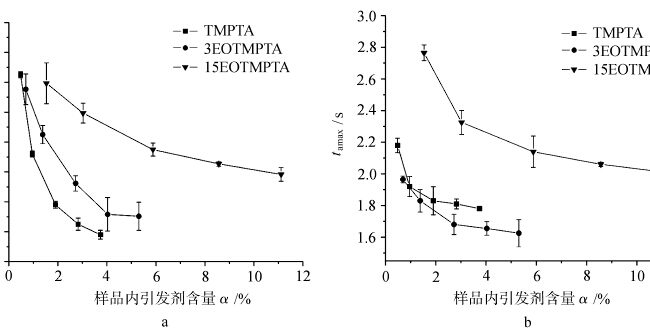
Figuur 4 toont de variatie van tamax met het initiatorgehalte in het monster voor de lichtuitharding van TMPTA monomeren met verschillende EOizations onder lucht en stikstof. Zoals te zien is in de figuur, neemt de tamax van elk monomeer dat is gefotocured onder lucht en stikstof af met de toename van het initiatorgehalte. De variatie van de lichtuithardende tamax van elk monomeer onder lucht en stikstof varieert met de hoeveelheid EO in het monomeer. Hieruit blijkt dat de hoeveelheid EO in het monomeer van invloed is op de tamax van lichtuitharding. Voor hetzelfde monomeer is het verschil in de lichtuithardende tamax onder lucht en stikstof gerelateerd aan de zuurstofbarrière wanneer de andere omstandigheden hetzelfde zijn.
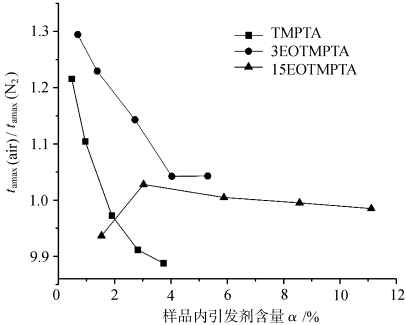
Figuur 5 toont de krommen van de verhouding van tamax van elk monomeer gefotocured onder verschillende atmosferen met de variatie van initiator inhoud α. tamax(lucht)/tamax(N2) geeft het verschil van tamax van monomeer gefotocured onder lucht en stikstof, waardoor de omvang van zuurstof blokkeren van elk monomeer gefotocured, hoe groter de waarde, hoe groter de zuurstof blokkerende werking. Zoals te zien is in figuur 5, waren de tamax(lucht)/tamax(N2) verhoudingen van monomeer TMPTA en monomeer 3EOTMPTA groter wanneer het initiatorgehalte klein was en namen ze af met toenemend initiatorgehalte. Dit geeft aan dat het monomeer TMPTA en monomeer 3EOTMPTA een significanter zuurstofblokkerend effect hebben als het initiatorgehalte laag is. Wanneer de hoeveelheid EO in het monomeer 15 bedraagt, ligt de tamax(lucht)/tamax(N2)-verhouding van het monomeer dicht bij 1, d.w.z., Er is weinig verschil in de tamax van lichtuitharding onder zowel lucht- als stikstofcondities, wat aangeeft dat de toename van de hoeveelheid EO in het monomeer gunstig is om de zuurstofblokkerende polymerisatie van UV-uitharding te verminderen, wat gerelateerd kan zijn aan de actieve waterstof in de EO-structuur. De etherachtige structuur in het EO-gedeelte De α-H op de -O-CH2- wordt gemakkelijk gesubstitueerd door zuurstof en de volgende reacties treden op.
De relatie van tamax(lucht)/tamax(N2) met het initatorgehalte in het uithardingsproces van verschillende geëthoxyleerde TMPTA.
Enerzijds kan α-H een deel van de zuurstof in het systeem verbruiken, anderzijds kan het het peroxideradicaal ROO- dat wordt gegenereerd door het radicaal en de zuurstof, beëindigen, waardoor het verbruik van reactieve radicalen wordt verminderd en de initiërende activiteit wordt omgeleid naar het ketensegment met initiërende activiteit, waardoor de zuurstofblokkering van het lichtuithardingsproces wordt verminderd .
2.3 Invloed van de hoeveelheid α-H in monomeren op de lichtuithardende zuurstofblokkerende aggregatie
Om het verband tussen zuurstofblokkering en de hoeveelheid α-H in de monomere EO-groepen te onderzoeken, werden de tamax-α curven in figuur 4 lineair gepast op verschillende vergelijkingen, en het bleek dat de hoogste correlatiecoëfficiënt werd verkregen door lineair passen van de vergelijking lnt=a+b/α0,5. De hellingen b verkregen uit de fits en de correlatiecoëfficiënten R staan in tabel 2.
| De waarde van b en R door lineaire fit 1/α0,5 en lnt | ||||
| Monomeer | lucht | N2 | ||
| b | R | b | R | |
| TMPTA | 0.056 | 0.99894 | 0.0213 | 0.95494 |
| EO3TMPTA | 0.0554 | 0.95877 | 0.0257 | 0.98564 |
| 15EOTMPTA | 0.0531 | 0.96578 | 0.062 | 0.98944 |
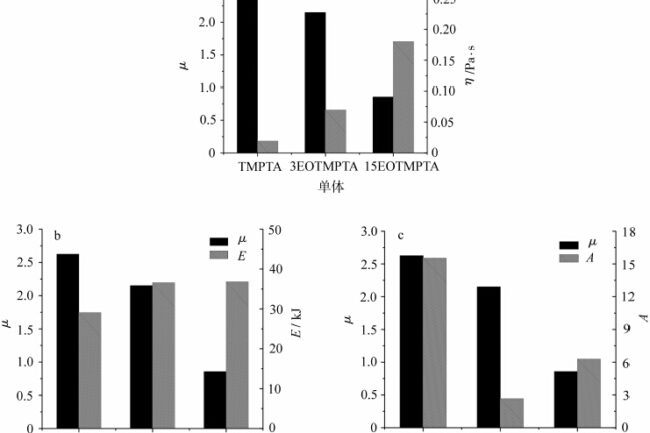
Bij vergelijking van de μ-waarden die overeenkomen met verschillende monomeren in figuur 6, heeft μ een maximumwaarde wanneer het monomeer TMPTA is, d.w.z. het zuurstofblokkerende effect is het grootst wanneer het monomeer TMPTA UV-gehard is. Als de hoeveelheid EO in het monomeer toeneemt, neemt de hoeveelheid α-H in het monomeer toe en neemt de μ-waarde af, wat erop wijst dat de zuurstofbarrière verband houdt met de hoeveelheid α-H in het monomeer, dat de zuurstof en peroxideradicalen in het systeem insluit en de zuurstofbarrière verlicht. Viscositeit is een eigenschap die verband houdt met de moleculaire structuur, waarbij de vloei-eigenschappen van het monomeer een rol spelen, dus het is noodzakelijk om het effect van de vloei-eigenschappen van het monomeer op de zuurstofbarrièrepolymerisatie verder te bespreken.
2.4 Invloed van de stromingseigenschappen van monomeren op zuurstofbarrièreaggregatie
De stromingseigenschappen van het systeem zijn gerelateerd aan de structuur van het molecuul. In het algemeen geldt: hoe flexibeler de molecuulketen, hoe lager de rotatiebarrière binnen de keten, hoe korter het ketensegment als mobiele eenheid en hoe lager de activeringsenergie van de flexibele molecuulketen, hoe beter de mobiliteit. Hoe groter het molecuulgewicht, hoe groter de interne wrijvingsweerstand tegen moleculaire beweging en hoe slechter de mobiliteit [19]. Daarom zal de introductie van EO groepen in TMPTA monomeer de vloei-eigenschappen van het systeem veranderen. Met behulp van een reometer met een constante afschuifsnelheid van 19,1/min en een temperatuurstijgsnelheid van 2 °C/min werden de viscositeitscurves van elk monomeer gemeten met de temperatuur. De viscositeit-temperatuurcurves van elk monomeer werden gepast met de vergelijking van Arrhenius en de berekende stroomactiveringsenergie E, de pre-factor A en de viscositeit van het monomeer η bij 25 ℃ werden vermeld in tabel 3.
| De waarde van viscositeit η(25 ℃), stroomactiveringsenergie E en pre-exponentiële factor A van monomeren | |||
| Monomeer | η/Pa-s (25℃) | A/10-8 | E/J |
| TMPTA | 0.01934 | 15.53 | 29079.88 |
| 3EOTMPTA | 0.06948 | 2.65 | 36600.47 |
| 15EOTMPTA | 0.18016 | 6.28 | 36821.87 |
De stroomactiveringsenergie E is onder andere gerelateerd aan de moleculaire structuur en wordt beïnvloed door de stijfheid en flexibiliteit van de molecuulketen, de grootte en polariteit van de zijgroepen enz. De indexfrontfactor A is een constante die verband houdt met het molecuulgewicht. Om het verband tussen de stromingseigenschappen van monomeren en de zuurstofbarrière te onderzoeken, werden de μ-waarden van verschillende monomeren gecorreleerd met de overeenkomstige viscositeiten η, de stroomactiveringsenergie E en de prefactor A, zoals weergegeven in figuur 7.
Figuur 7 toont de vergelijking van μ-waarden van verschillende monomeren in relatie tot respectievelijk de stroomactiveringsenergie E, de vingerfrontfactor A en de viscositeit η. Zoals te zien is in fig. 7a, neemt de μ-waarde af naarmate het aantal EO in het monomeer toeneemt en de viscositeit van het monomeer toeneemt. Hoe groter de zuurstofconcentratie, hoe duidelijker de zuurstofblokkering [7]. In het inwendige van het lichtuithardende systeem is de hoeveelheid opgeloste zuurstof zeker, en de snelheid waarmee vrije radicalen door zuurstof in het lichtuithardende proces worden gedoofd en weggespoeld is extreem hoog, en de verbruikte zuurstof wordt voornamelijk aangevuld door de diffusie van zuurstof uit de lucht naar het inwendige van het systeem, wat zeker het vermogen van zuurstofbeweging in het systeem met zich meebrengt, en het vermogen van zuurstofbeweging in het systeem is gerelateerd aan de viscositeit van het systeem. Wanneer de viscositeit van het systeem laag is, kan de zuurstof in de lucht gemakkelijker naar het inwendige van het systeem diffunderen, wat een groter zuurstofblokkerend effect heeft, waardoor de μ-waarde van het monomeer TMPTA hoger is en aanzienlijk wordt geblokkeerd door zuurstof. Wanneer de viscositeit van het systeem toeneemt, neemt het vermogen tot zuurstofverplaatsing in het systeem af en is het te laat om de zuurstof die is verbruikt door het wegvangen van vrije radicalen weer aan te vullen, waardoor de zuurstofblokkering afneemt. Zoals te zien is in de figuur, wanneer de hoeveelheid EO in het monomeer toeneemt tot 15, blijft de viscositeit van het monomeer toenemen en neigt de μ-waarde naar 1, d.w.z. het verschil tussen lichtuitharding onder lucht en stikstof is niet significant.
Vergelijk vervolgens de stroomactiveringsenergie en de vingerfrontfactor van het monomeer met de μ-waarde. Zoals te zien is in figuur 7b neemt de stroomactiveringsenergie van het monomeer toe van TMPTA tot 3EOTMPTA met de introductie van EO-groepen in het monomeer. Toen de hoeveelheid EO in het monomeer werd verhoogd van 3 tot 15, bleef de stroomactiveringsenergie in principe onveranderd, wat aangeeft dat het verhogen van de hoeveelheid EO in het monomeer in principe geen effect heeft op de stroomactiveringsenergie. Dit komt omdat, hoewel het aantal EO in het monomeer toeneemt, het aantal kinematische eenheden niet verandert, wat laat zien dat voor het TMPTA-monomeer met EO het effect van de stroomactiveringsenergie op de zuurstofbarrière niet significant is. Zoals te zien is in fig. 7c, verandert de vingerprefactor A sterk van TMPTA naar 3EOTMPTA, wat verband kan houden met de aan- of afwezigheid van EO-groepen. Met de toename van het aantal EO in het monomeer neemt de prefactor A toe, wat komt door de toename van het aantal EO in het monomeer, wat leidt tot een toename van het moleculaire gewicht van het monomeer. Er kan worden aangetoond dat voor TMPTA-monomeren met EO's de toename van het aantal EO's in het molecuul leidt tot een toename van het molecuulgewicht, wat leidt tot een toename van de viscositeit van het monomeer en dus de zuurstofbarrière verlaagt. Bij polymere materialen kan de viscositeit van het systeem over het algemeen worden verhoogd door de stijfheid van de molecuulketen te verhogen, de polariteit van de zijgroepen te verhogen, het molecuulgewicht te verhogen, enz. Er kan worden gespeculeerd dat de nadelige effecten van zuurstofblokkering door lichtuitharding kunnen worden verminderd door een geschikte samenstelling van de formulering, zoals het introduceren van structuren die actieve waterstof bevatten, het verhogen van het aandeel stijve moleculen en het verhogen van het molecuulgewicht.
3 Conclusie
(1) Het verhogen van het aantal EO-groepen in het monomeermolecuul kan de zuurstofblokkerende aggregatie tijdens het lichtuithardingsproces verminderen. Dit heeft te maken met het vangen van zuurstof en peroxideradicalen door de α-H in deze groep en de toename van de viscositeit van het systeem.
(2) Voor verschillende TMPTA's met EO die voor dit onderzoek zijn geselecteerd, heeft de stroomactiveringsenergie van het monomeer weinig effect op de zuurstofbarrièreaggregatie. De toename van de hoeveelheid EO in het monomeer leidt tot een toename van het molecuulgewicht, wat leidt tot een toename van de viscositeit van het monomeer, wat weer een effect heeft op de zuurstofbarrièreaggregatie.
UV-monomeer Producten uit dezelfde serie
| Polythiol/Polymercaptan | ||
| DMES-monomeer | Bis(2-mercaptoethyl)sulfide | 3570-55-6 |
| DMPT monomeer | THIOCURE DMPT | 131538-00-6 |
| PETMP monomeer | 7575-23-7 | |
| PM839 Monomeer | Polyoxy(methyl-1,2-ethaandiyl) | 72244-98-5 |
| Monofunctioneel monomeer | ||
| HEMA monomeer | 2-hydroxyethylmethacrylaat | 868-77-9 |
| HPMA-monomeer | 2-hydroxypropylmethacrylaat | 27813-02-1 |
| THFA-monomeer | Tetrahydrofurfuryl acrylaat | 2399-48-6 |
| HDCPA monomeer | Gehydrogeneerd dicyclopentenylacrylaat | 79637-74-4 |
| DCPMA-monomeer | Dihydrodicyclopentadieenylmethacrylaat | 30798-39-1 |
| DCPA monomeer | Dihydrodicyclopentadieenylacrylaat | 12542-30-2 |
| DCPEMA monomeer | Dicyclopentenyloxyethylmethacrylaat | 68586-19-6 |
| DCPEOA monomeer | Dicyclopentenyloxyethylacrylaat | 65983-31-5 |
| NP-4EA monomeer | (4) geëthoxyleerd nonylfenol | 50974-47-5 |
| LA Monomeer | Laurylacrylaat / Dodecylacrylaat | 2156-97-0 |
| THFMA-monomeer | Tetrahydrofurfurylmethacrylaat | 2455-24-5 |
| PHEA-monomeer | 2-FENOXYETHYLACRYLAAT | 48145-04-6 |
| LMA monomeer | Laurylmethacrylaat | 142-90-5 |
| IDA-monomeer | Isodecylacrylaat | 1330-61-6 |
| IBOMA Monomeer | Isobornylmethacrylaat | 7534-94-3 |
| IBOA Monomeer | Isobornylacrylaat | 5888-33-5 |
| EOEOEA Monomeer | 2-(2-Ethoxyethoxy)ethylacrylaat | 7328-17-8 |
| Multifunctioneel monomeer | ||
| DPHA-monomeer | 29570-58-9 | |
| DI-TMPTA monomeer | DI(TRIMETHYLOLPROPAAN)TETRAACRYLAAT | 94108-97-1 |
| Acrylamidemonomeer | ||
| ACMO monomeer | 4-acryloylmorfoline | 5117-12-4 |
| Di-functioneel monomeer | ||
| PEGDMA-monomeer | Poly(ethyleenglycol)dimethacrylaat | 25852-47-5 |
| TPGDA monomeer | Tripropyleenglycol diacrylaat | 42978-66-5 |
| TEGDMA-monomeer | Triethyleenglycol dimethacrylaat | 109-16-0 |
| PO2-NPGDA monomeer | Propoxylaat neopentylene glycol diacrylaat | 84170-74-1 |
| PEGDA monomeer | Polyethyleenglycoldiacrylaat | 26570-48-9 |
| PDDA-monomeer | Ftalaat diethyleenglycoldiacrylaat | |
| NPGDA monomeer | Neopentyl glycol diacrylaat | 2223-82-7 |
| HDDA monomeer | Hexamethyleen-diacrylaat | 13048-33-4 |
| EO4-BPADA monomeer | GEËTHOXYLEERD (4) BISFENOL A-DIACRYLAAT | 64401-02-1 |
| EO10-BPADA monomeer | GEËTHOXYLEERD (10) BISFENOL A-DIACRYLAAT | 64401-02-1 |
| EGDMA-monomeer | Ethyleenglycol dimethacrylaat | 97-90-5 |
| DPGDA monomeer | Dipropyleenglycol Dienoaat | 57472-68-1 |
| Bis-GMA monomeer | Bisfenol A glycidylmethacrylaat | 1565-94-2 |
| Trifunctioneel monomeer | ||
| TMPTMA monomeer | Trimethylolpropaan trimethacrylaat | 3290-92-4 |
| TMPTA monomeer | Trimethylolpropaan triacrylaat | 15625-89-5 |
| PETA Monomeer | 3524-68-3 | |
| GPTA ( G3POTA ) Monomeer | GLYCERYL PROPOXY TRIACRYLAAT | 52408-84-1 |
| EO3-TMPTA monomeer | Geëthoxyleerd trimethylolpropaan triacrylaat | 28961-43-5 |
| Fotolijstmonomeer | ||
| IPAMA-monomeer | 2-isopropyl-2-adamantylmethacrylaat | 297156-50-4 |
| ECPMA-monomeer | 1-Ethylcyclopentylmethacrylaat | 266308-58-1 |
| ADAMA-monomeer | 1-Adamantylmethacrylaat | 16887-36-8 |
| Methacrylaten monomeer | ||
| TBAEMA monomeer | 2-(Tert-butylamino)ethylmethacrylaat | 3775-90-4 |
| NBMA-monomeer | n-Butylmethacrylaat | 97-88-1 |
| MEMA monomeer | 2-Methoxyethylmethacrylaat | 6976-93-8 |
| i-BMA monomeer | Isobutylmethacrylaat | 97-86-9 |
| EHMA Monomeer | 2-Ethylhexylmethacrylaat | 688-84-6 |
| EGDMP monomeer | Ethyleenglycol Bis(3-mercaptopropionaat) | 22504-50-3 |
| EEMA Monomeer | 2-ethoxyethyl 2-methylprop-2-enoaat | 2370-63-0 |
| DMAEMA monomeer | N,M-dimethylaminoethylmethacrylaat | 2867-47-2 |
| DEAM-monomeer | Diethylaminoethylmethacrylaat | 105-16-8 |
| CHMA-monomeer | Cyclohexylmethacrylaat | 101-43-9 |
| BZMA-monomeer | Benzylmethacrylaat | 2495-37-6 |
| BDDMP monomeer | 1,4-Butaandiol Di(3-mercaptopropionaat) | 92140-97-1 |
| BDDMA monomeer | 1,4-butaandioldimethacrylaat | 2082-81-7 |
| AMA Monomeer | Allylmethacrylaat | 96-05-9 |
| AAEM monomeer | Acetylacetoxyethylmethacrylaat | 21282-97-3 |
| Acrylaten monomeer | ||
| IBA-monomeer | Isobutylacrylaat | 106-63-8 |
| EMA monomeer | Ethylmethacrylaat | 97-63-2 |
| DMAEA-monomeer | Dimethylaminoethyl acrylaat | 2439-35-2 |
| DEAEA-monomeer | 2-(diethylamino)ethylprop-2-enoaat | 2426-54-2 |
| CHA monomeer | cyclohexyl prop-2-enoaat | 3066-71-5 |
| BZA Monomeer | benzyl prop-2-enoaat | 2495-35-4 |