PVC is een van de meest gebruikte polymeren in de markt van vandaag, en het speelt een belangrijke rol op het gebied van bouwmaterialen en elektronische verpakkingen. Echter, PVC in de externe factoren (zoals warmte, zuurstof, licht en kracht, enz.) onder de werking van degradatie en verknoping reactie, wat resulteert in PVC-producten verkleuring, verzwakking van de mechanische eigenschappen.PVC verwarmd tot 110 ℃ zal HCl gas, zodat PVC begon te ontbinden. Op dit moment zijn PVC-hittestabilisatoren voornamelijk vijf soorten: loodzouten hittestabilisatoren, metaalzeep hittestabilisatoren, organotin hittestabilisatoren, organische hittestabilisatoren en zeldzame aarde hittestabilisatoren. Door loodzouten hittestabilisatoren hebben zware metalen, ernstige milieuvervuiling, wordt nu zelden gebruikt. Metal zeep type hittestabilisatoren aanvankelijk slechte anti-kleur vermogen, PVC afbraak van onstabiele chlooratoom substitutie vermogen is slecht, om de marktvraag te voldoen. Organische tin hittestabilisatoren hebben een aanzienlijk stabiliserend effect, maar sommige van hen zijn giftig en hoge kosten, die de ontwikkeling ervan beperkt. Organische hittestabilisatoren zijn niet giftig en milieuvriendelijk, maar de stabiliteit van alleen PVC-hittestabilisatoren is slecht. Er is meer onderzoek gedaan naar zeldzame aardwarmtestabilisatoren, die de voordelen hebben van lage toxiciteit, milieubescherming en goede thermische stabiliteit.
Met de ontwikkeling en innovatie van wetenschap en technologie is milieubescherming een belangrijk criterium geworden voor hittestabilisatoren, dus hebben stikstofhoudende heterocyclische carboxylzuur hittestabilisatoren veel aandacht gekregen. Dit komt omdat de hittestabilisatorsamenstelling geen zware metalen bevat, wat het vervuilingsprobleem oplost, en het is ook een uitstekend ligand met een goede thermische stabiliteit. Door de stikstofhoudende heterocyclische carboxylzuur hittestabilisatoren te combineren met zeldzame aardezoutoplossingen, kan een nieuw type stikstofhoudende heterocyclische carboxylzuur zeldzame aarde hittestabilisator worden gesynthetiseerd. De voordelen zijn lage toxiciteit, milieubescherming, goede lichttransmissie, goede thermische stabiliteit, lage kosten, hoge opbrengst en hoog ontwikkelingspotentieel. Liu Zhaogang et al. gebruikten imidazool ⁃ 4,5 ⁃ dicarbonzuur, natriumhydroxide, lanthaanchloride als grondstoffen voor de bereiding van een stikstofbevattend heterocyclisch carbonzuur zeldzame aardmetalen hittestabilisatoren, en gebruikten vervolgens de statische hittestabilisatie-experimenten en dynamische hittestabilisatie-experimenten om een verdere studie uit te voeren, en ontdekten dat het bereidingsproces relatief omslachtig is en de reactietijd relatief lang is, maar dat het product van de thermische stabiliteit van het complex nog steeds goed is. Zhang Ning en anderen synthetiseerden 8 soorten lanthaan aminozuur hittestabilisatoren met aminozuren, natriumhydroxide en lanthaannitraat als grondstoffen, en bestudeerden verder statische hittestabilisatie-experimenten en dynamische hittestabilisatie-experimenten, en vergeleken de hittestabiliteit van 8 soorten lanthaan aminozuren, en ontdekten dat de 8 soorten lanthaanaminozuren benzeenring en zwavel bevatten, wat giftig en niet milieuvriendelijk was, en dat tryptofaan onder de 8 soorten aminozuurgrondstoffen benzeenring bevatte, maar dat de hittestabiliteit van lanthaan tryptofaan beter was dan die van 8 soorten aminozuren, en dat de hittestabiliteit van lanthaan tryptofaan beter was dan die van 8 soorten aminozuren. De thermische stabiliteit van lanthaan tryptofaan is echter het beste onder de 8 soorten lanthaanaminozuren, en de activeringsenergie van de samengestelde hittestabilisator is beter dan die van lanthaan tryptofaan monomeer en commercieel beschikbare calcium en zink hittestabilisatoren, die de thermische stabiliteit van PVC kunnen verbeteren.
In dit document werd 2,3⁃PDA gesynthetiseerd als een ligand van lanthaan element bij pH=6~7. 2,3⁃LPDA werd gebruikt als de belangrijkste hittestabilisator van PVC voor hittestabiliteitsstudie, en vervolgens werd het samengesteld met hulp hittestabilisatoren zoals calciumstearaat, zinkstearaat, pentaerythritol, enz, De hittestabiliteit van het samengestelde systeem werd vergeleken met die van 2,3⁃LPDA en de thermische stabilisatie van het deel van de hitte De effecten van sommige hittestabilisatoren op de weekmakende en mechanische eigenschappen van PVC werden gekarakteriseerd; tot slot werd het hittestabilisatiemechanisme van 2,3⁃LPDA onderzocht.
1
Monstervoorbereiding
2,3⁃LPDA-bereiding: weeg de juiste hoeveelheid lanthaanoxyde in een bekerglas, voeg gedeïoniseerd water en roer goed; zet het bekerglas in de 60 ℃ waterbad verwarming, roeren de lanthaanoxyde waterige oplossing met een roerder, en gebruik vervolgens de druppelaar langzaam salpeterzuur oplossing toe te voegen aan de oplossing van lanthaanoxyde is volledig opgelost; de pH-waarde van de oplossing werd bepaald op 3 ~ 4 door pH-papier voor filtratie, het filtraat verkregen voor de oplossing van lanthaan nitraat, en gegoten in een reagens fles voor reserve, en de molaire waarde was 0.015 mg/L. De oplossing werd gefiltreerd en vervolgens in een reagensfles gegoten. Reagensfles reserve, de molaire concentratie bepaald door EDTA titratie, het wegen van de molaire verhouding van 3. De oplossing werd gefilterd en vervolgens in een reagensfles gegoten:2 2,3 ⁃ PDA en lanthaan nitraat, zal de eerste watervrije ethanol 2,3 ⁃ PDA poeder opgelost, en vervolgens ammoniak verdunnen om de pH aan te passen tot 6 ~ 7, in constant roeren van het lanthaan nitraat oplossing langzaam wordt toegevoegd aan de watervrije ethanol oplossing van 2,3 ⁃ PDA, en vervolgens ammoniak verdunnen om de pH van het systeem aan te passen aan 6 ~ 7, wat resulteert in een wit neerslag, met een elektrische roerder. Wit neerslag, geroerd met een elektrische roerder gedurende 3 uur om het systeem volledig reactief, en vervolgens links om het neerslag te laten neerslaan alle neergeslagen, en vervolgens gefiltreerd, en vervolgens het neerslag gewassen met watervrije ethanol voor meerdere malen; de composiet werd gedroogd bij 50 ℃ tot een constant gewicht, en het resulterende product was 2,3 ⁃ LPDA zeldzame aardmetalen warmte stabilisatoren, en vervolgens het product werd vermalen tot een poeder en vervolgens verpakt in een zak voor reserve gebruik;
Samenstelling hittestabilisator: 2,3 ⁃ LPDA met zinkstearaat en pentaerythritol volgens verschillende massaverhouding van binaire en ternaire samenstelling, wegen, malen en mengen van het poeder, in zakken doen reserve.
2
Resultaten en discussie
2.1 Karakterisering van 2,3⁃LPDA
2.1.1 Infraroodspectraalanalyse
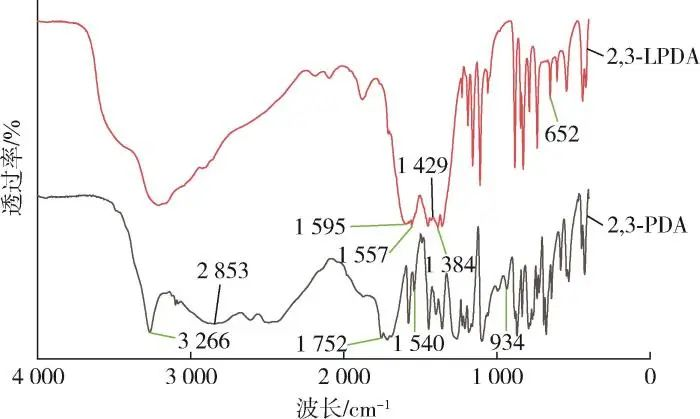
Figuur 1 toont de FTIR spectra van 2,3⁃PDA en 2,3⁃LPDA. Het is te zien dat de telescopische trillingspieken van C=N-binding in 2,3⁃PDA en 2,3⁃LPDA op 1.540 cm-1 en 1.557 cm-1 , respectievelijk; de telescopische trillingspieken van NO3- op 2,3⁃LPDA op 1.384 cm-1 ; de telescopische trillingspieken van de C=O-binding op 2,3⁃PDA op 1,752 cm-1 ; de telescopische trillingspieken van de C=O-binding op 2,3⁃PDA op respectievelijk 1,595 cm-1 en 1,429 cm-1 ; de telescopische trillingspieken van 2,3⁃PDA op respectievelijk 1,595 cm-1 en 1,429 cm-1. 1,595 cm-1 en 1,429 cm-1 zijn respectievelijk de antisymmetrische en symmetrische telescopische trillingspieken van de C=O-binding op 2,3⁃PDA; 3,266 cm-1 is de telescopische trillingspiek van de O-H-binding op 2,3⁃PDA; en 934 cm-1 is de karakteristiek brede piek van -COOH op 2,3⁃PDA, waarmee we kunnen vaststellen dat er carboxylaatgroepen aanwezig zijn; De strekvibratiepiek van de O-La-binding op 2,3⁃LPDA op 652 cm-1, wat aangeeft dat de reactie van 2,3⁃PDA met lanthaannitraat als ligand ervoor zorgde dat de O-H-binding in de carboxylaatgroep op 2,3⁃PDA de keten en de-H brak en een O-La-binding vormde met het La-ion. Samenvattend kan worden vastgesteld dat de reactie 2,3⁃LPDA produceerde.
Figuur 1 FTIR-spectrum van het monster
2.1.2 Elementaire en thermische analyse
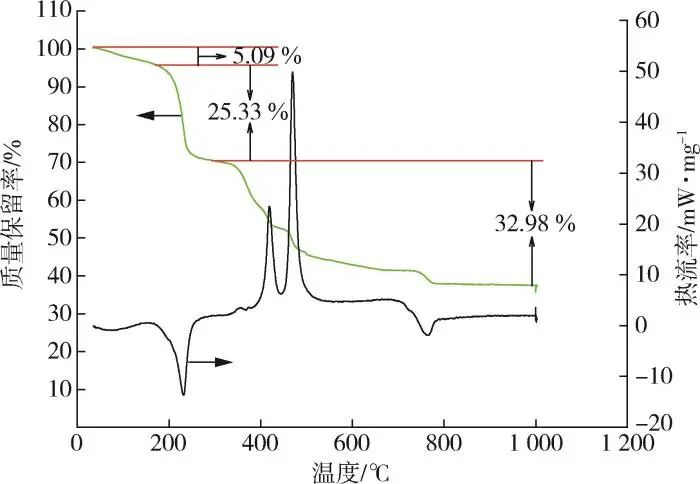
Het gehalte aan C, H en N in 2,3⁃LPDA werd bepaald door elementanalyse en het gehalte aan lanthaan werd bepaald door EDTA-titratie. Tabel 1 laat zien dat de relatieve fout van het element H-gehalte (massafractie, hetzelfde hieronder) groot is vanwege de kleine hoeveelheid en dat de werkelijke inhoud van andere elementen in principe overeenkomt met de theoretische inhoud. Vervolgens werd het aantal kristalwater berekend door de thermische analyseresultaten in Fig. 2, wat leidde tot de molecuulformule van 2,3⁃LPDA als La2(C6N2O4)2(NO3)2-3H2O. Uit de TG-curven in fig. 2 blijkt dat het thermische gewichtsverlies van 2,3⁃LPDA in drie fasen verdeeld was, namelijk van 50 tot 184, van 184 tot 292 en van 292 tot 1.000 ℃. Het massaverlies van de eerste fase was 5,09 % en uit het massaverlies kon worden afgeleid dat er drie kristallijne wateren waren, die vergelijkbaar waren met de 6. Het massaverlies van de eerste fase was 5,09 %.88 % kristallijn water in de molecuulformule La2(C6N2O4)2(NO3)2-3H2O zoals afgeleid uit tabel 1; de DSC-curve van de eerste fase had een warmteabsorptiepiek bij 87,1~140,6 ℃, die de verwijdering van kristallijn water uit 2,3 ⁃LPDA vertegenwoordigde. Uit de TG-curves van de tweede en derde fase kan worden opgemaakt dat 2,3 ⁃LPDA een klip gewichtsverlies vertoonde, met een totaal massaverlies van 58,31% in de tweede en derde fase; in tegenstelling tot de DSC-curves was er een inspirerende piek bij 184~292,4 ℃ in de tweede fase, die de ontleding van het product voorstelde. In de derde fase verschenen twee exotherme pieken, die de verdere ontleding van de producten vertegenwoordigden. Na 797 ℃ was er geen verder gewichtsverlies, en de TG-curve heeft de neiging om af te vlakken, en het uiteindelijke residu is La2O3, die goed is voor 36.59% van de massafractie, en het gehalte aan La is berekend op 31.11%, die vergelijkbaar is met de theoretische La-gehalte van 31.53% in tabel 1. Samenvattend werd de moleculaire formule van de hittestabilisator met zeldzame aardmetalen bepaald als La2(C6N2O4)2(NO3)2-3H2O door de gegevens in tabel 1 en figuur 2 te vergelijken.
Tabel 1 Elementaire analyseresultaten van 2,3⁃LPDA
Fig. 2 Thermische analysecurve van 2,3⁃LPDA
2.2 Thermische stabiliteitsanalyse
2.2.1 Enkelvoudige thermische stabilisator
Om de thermische stabiliteit van 2,3⁃LPDA diepgaander te kunnen bestuderen, werd de thermische stabiliteit vergeleken met respectievelijk gebruikelijke thermische stabilisatoren en de resultaten worden weergegeven in tabel 2. Tabel 2 laat zien dat de thermische stabilisatietijd van 2,3⁃LPDA 30 minuten is, wat 6 keer langer is dan die van 2,3⁃PDA, alleen korter dan die van loodstearaat en langer dan die van andere warmtestabilisatoren in de tabel. In termen van antikleuringprestaties heeft 2,3⁃LPDA betere initiële antikleuringprestaties dan 2,3⁃PDA, wat erop wijst dat 2,3⁃LPDA een sterker bindingsvermogen heeft met onstabiele Cl- en de initiële antikleuringprestaties van PVC verbetert. In termen van antikleuring op lange termijn is 2,3⁃LPDA iets zwakker dan calciumstearaat en pentaerytritol in antikleuring. Behalve calciumstearaat en pentaerytritol heeft 2,3⁃LPDA enkele voordelen ten opzichte van andere hittestabilisatoren wat betreft antikleuring, en het heeft een positief effect op het voorkomen van thermische degradatie van PVC.
Tabel 2 Thermische stabiliteit van verschillende warmtestabilisatoren
2.2.2 2,3⁃LPDA gemengd met zinkstearaat
De initiële verkleuringsweerstand van 2,3⁃LPDA is iets slechter dan die van zinkstearaat, maar de thermische stabilisatietijd en de verkleuringsweerstand op lange termijn zijn veel beter dan die van zinkstearaat. De thermische stabiliteitstestresultaten van de twee complexen worden getoond in tabel 3. Uit tabel 3 blijkt dat de langste thermische stabilisatietijd 34 minuten was wanneer de mengverhouding van 2,3⁃LPDA en zinkstearaat 4:1 was, en langer dan wanneer 2,3⁃LPDA alleen als thermische stabilisator werd gebruikt, en hoe groter het aandeel van 2,3⁃LPDA in de mengverhouding, hoe langer de thermische stabilisatietijd. Dit komt omdat Re3+ en Cl- sterke coördinatie-effecten hebben en gemakkelijker coördineren met Cl- dat door hitte wordt afgebroken. In termen van antikleuringprestaties waren de initiële antikleuringprestaties van de samengestelde hittestabilisatoren sterk verbeterd. Dit komt omdat 2,3 ⁃ LPDA initiële remming van zinkstearaat om "zinkverbranding" fenomeen te produceren duidelijk is, en er is een sterk synergetisch effect, de samenstelling van de initiële anti-verkleuring prestaties van PVC is sterk verbeterd. Echter, van de lange termijn anti-verkleuring prestaties, 2,3 ⁃ LPDA alleen is beter dan de samengestelde anti-verkleuring prestaties, en 2,3 ⁃ LPDA in de mengverhouding van de kleinere proportie, het "zink branden" fenomeen zal meer voor de hand liggende, hoe slechter de lange termijn anti-verkleuring, hoe korter de hittestabilisatietijd, wat erop wijst dat hoe meer het aandeel zinkstearaat in de samengestelde verhouding van hoe meer, hoe meer het aandeel van 2,3 ⁃ LPDA en zinkstearaat, en hoe meer het aandeel van 2,3 ⁃ LPDA en zinkstearaat, hoe meer het aandeel van 2,3 ⁃ LPDA en zinkstearaat. Hoe korter de hittestabilisatietijd, wat aangeeft dat hoe groter het aandeel zinkstearaat in de mengverhouding, hoe slechter het synergetische effect tussen LPDA en zinkstearaat.
Tabel 3 Thermische stabiliteit van zinkstearaatsamengestelde systemen
2.2.3 Samenstellen van 2,3⁃LPDA met pentaerytritol
Penta-erytritol is een hulphittestabilisator met een uitstekende thermische stabiliteit en de antikleuringprestaties op korte en lange termijn zijn goed. De thermische stabiliteit van 2,3⁃LPDA en gecomplexeerd pentaerytritol wordt weergegeven in tabel 4. Uit de tabel blijkt dat de thermische stabiliteit van de twee gecomplexeerde warmtestabilisatoren tussen 31-34 min. ligt en dat de thermische stabiliteit van 2,3 ⁃LPDA als alleen warmtestabilisator 30 min. bedroeg, wat aangeeft dat de thermische stabilisatietijd van 2,3 ⁃LPDA met pentaerytritol gecomplexeerd met zinkstearaat 30 min is, wat aangeeft dat het synergetische effect tussen 2,3 ⁃LPDA en zinkstearaat steeds belangrijker wordt. Het hittestabilisatie-effect van 3⁃LPDA en pentaerytritol is niet duidelijk, de hittestabilisatietijd is slechts 1-3 minuten langer, maar het heeft ook een zeker synergetisch effect. In termen van antikleuringprestaties is het effect van pentaerytritol erg duidelijk en de initiële antikleuringprestaties van de twee composieten zijn beter dan die van 2,3⁃LPDA alleen als hittestabilisator. Uit de antikleureffecten op de lange termijn blijkt dat hoe groter het aandeel pentaerytritol in de samengestelde hittestabilisator is, hoe beter de antikleureffecten op de lange termijn zijn, wat erop wijst dat de samenstelling van pentaerytritol en 2,3⁃LPDA goede antikleureffecten heeft en dat pentaerytritol de antikleureffecten op de lange termijn van 2,3⁃LPDA verder verbetert. Over het geheel genomen is het hittestabiliserende effect van pentaerytritol niet duidelijk, maar de antikleureigenschap is zeer prominent. Dit is te wijten aan het vermogen van de alcohol om de kleur van PVC te veranderen bij verhitting, en als de temperatuur toeneemt, wordt de alcohol veresterd, waardoor het moeilijker wordt voor de alcohol om uit het PVC neer te slaan. Tegelijkertijd kunnen pentaerytritol en lanthaan worden gecomplexeerd om de gebroken ketens in de molecuulketen tijdens de afbraak van PVC te compenseren, waardoor het vermogen van PVC om kleur te veranderen op lange termijn wordt verbeterd.
Tabel 4 Thermische stabiliteit van pentaerytritol complex systeem
2.2.4 Samenstelling van 2,3⁃LPDA, zinkstearaat en pentaerytritol
Het fenomeen van "zinkverbranding" veroorzaakt door zinkstearaat kan worden vertraagd door pentaerytritol. Om de hittestabilisatoren een beter vermogen tegen kleurverandering en een langere hittestabilisatietijd te geven, werden 2,3⁃LPDA, zinkstearaat en pentaerytritol samengesteld, en hun hittestabiliteit wordt weergegeven in tabel 5. Zoals blijkt uit tabel 5, was de thermische stabilisatietijd 44 minuten wanneer de verhouding 2,3⁃LPDA:zinkstearaat:pentaerytritol 2:1:2 was, wat hoger was dan die van de andere twee sets mengverhoudingen, wat volledig bewees dat er een sterk synergetisch effect was wanneer 2,3⁃LPDA en pentaerytritol hetzelfde aandeel hadden. Vanuit het oogpunt van antikleuring is de antikleuring van het samengestelde systeem sterk verbeterd door de toevoeging van pentaerytritol, en pentaerytritol vertraagt ook het optreden van het fenomeen zinkstearaat "zinkbrandwonden", waardoor de antikleuring van het systeem op lange termijn na de drie samenstellingen aanzienlijk is verbeterd. Uit een vergelijking van tabel 2, tabel 3 en tabel 5 blijkt dat de antikleuringsprestaties van het ternaire compoundingsysteem aanzienlijk beter zijn dan die van het binaire compoundingsysteem. Dit komt doordat de hittestabilisatoren van de polyolen tot op zekere hoogte het optreden van zinkstearaatverbranding kunnen voorkomen en doordat het complex dat ontstaat door de reactie tussen pentaerytritol en zinkstearaat het katalytische effect van ZnCl2 op de afbraak van PVC effectief kan verzwakken.
Tabel 5 Thermische stabiliteit van het ternaire compoundsysteem
2.3 Analyse van plastificerende eigenschappen
In dit onderzoek werden weekmakingsexperimenten uitgevoerd met verschillende hittestabilisatoren om het effect van hittestabilisatoren op de dynamische thermische stabiliteit van PVC te bestuderen. Zoals uit de tabel blijkt, was de plastificatietijd van het hittestabilisatormonster met zinkstearaat en 2,3⁃LPDA het langst. Dit komt omdat zinkstearaat alleen plastificeren, plastificerende prestaties is zeer slecht, aan het einde van het laden, zal onmiddellijk verschijnen "zink branden" fenomeen, het fenomeen zal de afbraak van PVC te bevorderen, kan niet realiseren van de plastificering, en met 2,3 ⁃ LPDA complex, 2,3 ⁃ LPDA een rol gespeeld in het vertragen van de "zink branden" fenomeen, het effect van de "zink branden" fenomeen. "Na de weekmakerpiek begon zinkstearaat de afbraak van PVC te bevorderen, wat leidde tot de versnelde afbraak van PVC-poeder. Hoewel de plastificatietijd van het monster dat ternaire warmtestabilisator bevat iets langer is dan die van het monster dat 2,3 ⁃LPDA bevat, zijn het plastificeerkoppel en het evenwichtskoppel lager, wat erop wijst dat het de hechting tussen PVC en de verwerkingsmachines tijdens het proces kan verminderen, waardoor het energieverlies en het stroomverbruik afnemen.
Tabel 6 Weekmakingseigenschappen van verschillende monsters
2.4 Analyse van de trekeigenschappen
Volgens de resultaten van de statische hittestabilisatie-experimenten werden de hittestabilisatoren met zeldzame aarden met de beste hittestabilisatieprestaties in elke groep experimenten geselecteerd voor de trekproef om het effect van verschillende hittestabilisatoren op de trekeigenschappen van PVC te bestuderen. De resultaten zijn weergegeven in Tabel 7. Uit de tabel blijkt dat de trekeigenschappen van PVC significant verbeterden nadat 2,3⁃LPDA aan PVC was toegevoegd; het verschil in trekeigenschappen tussen de warmtestabilisatormonsters die 2,3⁃LPDA en zinkstearaat bevatten en de trekeigenschappen van de monsters die 2,3 ⁃LPDA bevatten groot was, wat te wijten kan zijn aan het feit dat een deel van het zinkstearaat het fenomeen van "zinkverbranding" bleek te hebben bij het mengen van de PVC-plaat, wat de degradatie van PVC bevorderde. Dit kan te wijten zijn aan het fenomeen van "zinkverbranding" van sommige zinkstearaten tijdens het mengen van PVC-vlokken, wat de afbraak van PVC bevordert en de treksterkte van PVC-vlokken vermindert, wat resulteert in de slechte mechanische eigenschappen van PVC-vlokken. De laatste gegevens in tabel 7 laten zien dat 2,3⁃LPDA, zinkstearaat en pentaerytritol het beste effect hebben op de verbetering van de treksterkte van PVC. Dit kan te wijten zijn aan de zeldzame aardelementen hebben veel lege orbitalen om het eenzame elektron van het ligand te accepteren, terwijl de zeldzame aardmetaalionen een grote ionstraal hebben, zodat het en de organische en anorganische stoffen in de PVC-formule een verscheidenheid aan liganden of chelaten vormen, waardoor de intermoleculaire interactiekracht toeneemt, het PVC een plastificerend effect speelde en de treksterkte van PVC-materialen verbeterde.
Tabel 7 Mechanische eigenschappen van verschillende monsters
2.5 Mechanisme voor hittestabilisatie
De FTIR spectra van 2,3⁃LPDA voor en na HCl behandeling worden getoond in Fig. 3. Uit de figuur blijkt dat het FTIR-spectrum van 2,3⁃LPDA na HCl-behandeling het golfgetal van de C=N-binding verschoof van een laag golfgetal naar een hoog golfgetal in vergelijking met onbehandeld, en het golfgetal van de C=N-binding na behandeling was 1.572 cm-1. Bovendien verdween de telescopische vibratiepiek van NO3- uit de curven na HCl-behandeling. Bovendien verdween de telescopische trillingspiek van NO3- uit de curves na de behandeling met HCl vanwege het feit dat H+ zich met NO3- verbindt tot HNO3. Echter, door de combinatie van H+ en NO3- om HNO3 te vormen bij de behandeling van 2,3⁃LPDA met HCl, is het niet mogelijk om het thermische stabilisatiemechanisme van 2,3⁃LPDA te bepalen. Bij de HCl-behandeling van 2,3⁃LPDA is de HCl-oplossing exotherm, terwijl HNO3 gemakkelijk ontleedt in H2O, NO2 en O2 onder omstandigheden bij hoge temperatuur, wat geen invloed heeft op de thermische stabiliteitseigenschappen van 2,3⁃LPDA. In het FTIR-spectrum van onbehandeld 2,3⁃LPDA ligt de piek van de strekvibratie van de O-La-binding op 652 cm-1. Na de behandeling waren er nog twee karakteristieke pieken van de O-La-binding. Na de behandeling waren er nog twee karakteristieke pieken van de O-H-binding in de FTIR-spectra, de telescopische trillingspiek van de O-H-binding op 1.445 cm-1 en de out-of-plane telescopische trillingspiek van de O-H-binding op 1.097 cm-1, en de spectra verschenen weer met de karakteristieke piek van de - COOH-binding. Uit het bovenstaande kan worden afgeleid dat de O-La-binding werd verbroken en de O-H-binding werd gerecombineerd na de behandeling, en nadat de O-La-binding was verbroken, combineerden de La-ionen met de Cl-ionen om de La-Cl-binding te vormen, en uit de FTIR-spectra van de behandelde 2,3 ⁃LPDA werd een extra piek op 1.261 cm-1 gevonden in de FTIR-spectra van 2,3 ⁃LPDA. In het FTIR-spectrum van 2,3⁃LPDA na behandeling is er een piek van 1.261 cm-1 , wat de strekvibratiepiek is van de La ⁃Cl-binding. Men kan zien dat 2,3⁃LPDA met HCl reageerde om LaCl3 te vormen, dus men kan weten dat het stabilisatiemechanisme van 2,3⁃LPDA is dat 2,3⁃LPDA het HCl-gas dat vrijkomt tijdens de thermische afbraak van PVC effectief kan absorberen en LaCl3 kan vormen, wat het katalytische effect van de thermische afbraak van PVC tot op zekere hoogte kan vertragen.