Panoramica dei metodi di immobilizzazione degli enzimi
Nell'articolo precedente abbiamo detto che le sostanze amare degli agrumi sono principalmente la naringina, che può essere gradualmente decomposta in glucosio e naringenina dalla naringinasi, raggiungendo infine lo scopo della deamarizzazione. Nell'attuale processo di produzione e utilizzo, rispetto agli enzimi liberi, gli enzimi immobilizzati non solo hanno una maggiore efficienza catalitica e una migliore specificità, ma migliorano anche la resistenza alle condizioni difficili e prolungano la vita utile degli enzimi; allo stesso tempo, gli enzimi immobilizzati sono comodi da separare dal prodotto di reazione, semplificano il processo di produzione e riducono i costi. Ecco quindi una breve introduzione ai metodi di immobilizzazione degli enzimi più comuni.
L'enzima immobilizzato si riferisce a un enzima che viene fissato su un determinato supporto per formare l'insolubilità in acqua, pur mantenendo le proprietà catalitiche. Già nel 1954, Glubhofer e Schleith utilizzarono il metodo diazo per modificare la resina di polistirene per l'immobilizzazione di pepsina e carbossipeptidasi per preparare enzimi immobilizzati. Nel 1969, poi, lo scienziato giapponese Chi Yanichiro utilizzò l'aminoacido acilato immobilizzato per realizzare per la prima volta la produzione continua di L-aminoacido, promuovendo il rapido sviluppo della tecnologia di immobilizzazione nell'ingegneria enzimatica. Quando sono apparsi gli enzimi immobilizzati, esistevano molti nomi diversi, ma alla prima Conferenza Internazionale di Ingegneria Enzimatica del 1971, è stato formalmente proposto di usare "enzimi immobilizzati" come termine appropriato. La reazione catalizzata da un enzima presenta condizioni blande, elevata efficienza catalitica e alta specificità. Allo stesso tempo, l'enzima è facile da degradare e rispetta l'ambiente. L'enzima immobilizzato non solo mantiene queste caratteristiche dell'enzima, ma possiede anche molte proprietà difficili da possedere per gli enzimi liberi, quali: ① facilità di separazione dal sistema di reazione; ② riciclabilità; ③ miglioramento della stabilità dell'enzima in condizioni difficili; ④ possibilità di realizzare la catalisi enzimatica in fase non acquosa; ⑤ possibilità di produrre un sistema multi-enzimatico a reazione continua. Poiché gli enzimi immobilizzati possono avere un importante valore applicativo nei settori della medicina, dell'alimentazione, della protezione dell'ambiente, ecc.
I metodi comuni di immobilizzazione degli enzimi includono principalmente il metodo di adsorbimento, il metodo di incorporazione, il metodo di reticolazione e il metodo di accoppiamento covalente. I primi due appartengono al metodo fisico, mentre gli ultimi due appartengono al metodo chimico. Il principio di questi metodi per l'immobilizzazione dell'enzima è illustrato nella Figura 1.
Figura 1 Metodo di immobilizzazione dell'enzima
1 Metodo di adsorbimento
Il metodo di adsorbimento è un metodo per completare l'immobilizzazione attraverso l'adsorbimento superficiale del vettore all'enzima o attraverso l'interazione di carica positiva e negativa tra il vettore e l'enzima, compreso l'adsorbimento fisico e l'adsorbimento ionico.
-
adsorbimento fisico
Il metodo di adsorbimento fisico è un metodo per fissare l'enzima sulla superficie del vettore utilizzando l'effetto di adsorbimento del vettore sull'enzima. Il metodo è semplice da utilizzare, non richiede modifiche e attivazione, e il centro attivo dell'enzima è ben conservato, ma la forza di legame è bassa e la sua forza è principalmente intermolecolare e di tensione superficiale. Gli adsorbenti comunemente utilizzati per l'immobilizzazione degli enzimi includono il carbone attivo, il grafene, la terra di diatomee e altri adsorbenti non solubili in acqua con una forte capacità di assorbimento dell'acqua. Zhao et al. hanno utilizzato l'ossido di grafene ridotto come supporto per co-immobilizzare la glucosio ossidasi e la glucoamilasi per preparare un enzima composito immobilizzato.
-
adsorbimento degli ioni
Il metodo di adsorbimento ionico è un metodo di immobilizzazione dell'enzima attraverso l'interazione di carica positiva e negativa tra il vettore e l'enzima. Il metodo prevede condizioni di preparazione blande e l'attività dell'enzima non è facile da perdere, ma anche la forza di legame è debole e facile da perdere. Mateo et al. hanno preparato un nuovo tipo di resina a scambio ionico per fissare rispettivamente la lipasi, la β-galattosidasi e l'amminoacido ossidasi. In condizioni di pH 7,0 e 4 ℃, l'enzima può raggiungere la saturazione dell'adsorbimento in pochi minuti e il tasso di recupero dell'attività enzimatica può arrivare a 100%, dimostrando un buon effetto di immobilizzazione.
2 Metodo di incorporazione
Il metodo di incorporazione è un metodo in cui l'enzima è incorporato in un materiale poroso e comprende il metodo di incorporazione in gel e il metodo di incorporazione in membrana semipermeabile. Il metodo di incorporazione in gel è un metodo di fissazione in cui l'enzima è incorporato nella struttura interna della rete del gel (Figura 1B-a). Zhang Shuxiang e altri hanno utilizzato l'alginato di sodio per incorporare la laccasi fungina e trattare le acque reflue di produzione della carta a bassa concentrazione. Il tasso massimo di recupero dell'attività enzimatica è stato di 48% e l'attività enzimatica è rimasta di 64% dopo 8 prove. Il metodo di incorporazione in membrana semipermeabile è un metodo di immobilizzazione degli enzimi in una membrana semipermeabile fatta di polimeri ad alto contenuto molecolare (Figura 1B-b). Anche questo metodo non richiede modifiche chimiche e non influisce sull'attività dell'enzima, ma non è facile controllare le dimensioni della membrana. È difficile mantenere l'attività enzimatica controllando l'entrata e l'uscita libera di reagenti e prodotti senza perdite di enzima. Pertanto, nell'uso pratico questo metodo viene solitamente combinato con altri metodi. Rilling P et al. hanno utilizzato un vettore per immobilizzare le molecole proteiche insieme in una microcapsula, che non solo ha aumentato la stabilità dell'enzima immobilizzato, ma ne ha anche migliorato le proprietà.
3 Metodo di reticolazione
Il metodo di reticolazione è un metodo in cui le molecole di enzima sono reticolate tra loro utilizzando reagenti bifunzionali o multifunzionali, e le molecole di enzima e i reagenti formano un legame covalente e vengono fissati. L'enzima immobilizzato preparato con questo metodo ha una buona stabilità, ma alcuni gruppi dell'enzima, come quelli amminici, sulfidrilici, imidazolilici, ecc. possono partecipare alla reazione di reticolazione. Se l'agente reticolante e il gruppo funzionale selezionati non sono appropriati, la struttura del centro attivo dell'enzima può essere distrutta, con conseguente grave perdita di attività enzimatica, per cui questo metodo viene solitamente combinato con altri metodi. Li Xiaojing e altri hanno prima incapsulato la pepsina con una soluzione di alginato di sodio, poi l'hanno aggiunta a goccia a goccia a una soluzione contenente una certa concentrazione di chitosano e CaCl2 per ottenere microsfere di enzima immobilizzato, quindi si è aggiunta una certa quantità di glutaraldeide per la reticolazione e si è ottenuta la pepsina immobilizzata. Questo metodo ha permesso di ottenere un enzima immobilizzato con una buona stabilità operativa e termica.
4 Metodo di accoppiamento covalente
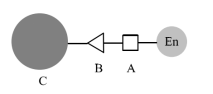
Il metodo di accoppiamento covalente (noto anche come metodo di legame covalente) è un metodo di immobilizzazione dell'enzima mediante la formazione di un legame covalente tra l'enzima e il vettore (come mostrato nella Figura 2).
Figura 2 Enzima immobilizzato con il metodo del legame covalente, A- residuo aminoacidico attivo; B-gruppo legante sul carrier; C-carrier.
I metodi di legame covalente includono generalmente tre tipi: (1) il vettore viene modificato e attivato, quindi legato covalentemente alla molecola enzimatica; (2) il vettore e la molecola enzimatica sono legati covalentemente attraverso un agente di accoppiamento; (3) la molecola enzimatica viene modificata dopo l'attivazione e combinata con il vettore. Tra questi, il primo tipo è quello più comunemente utilizzato. Dopo aver attivato il vettore per collegare alcuni gruppi attivi come l'amino, l'epossidico, ecc. al residuo attivo della molecola enzimatica (come l'amino, il carbossile, l'idrossile, ecc.), l'enzima viene immobilizzato. Questo metodo è molto più affidabile del metodo di adsorbimento. Allo stesso tempo, poiché il vettore è generalmente più grande, i residui aminoacidici coinvolti nella reazione sull'enzima sono generalmente quelli esposti alla periferia dell'enzima e l'effetto sul centro attivo dell'enzima è relativamente piccolo. Si tratta di un metodo eccellente per immobilizzare gli enzimi. Yan Keliang e altri hanno utilizzato nanoparticelle magnetiche aminosilanizzate per immobilizzare la pectinasi; il tasso di immobilizzazione e il tasso di recupero dell'attività enzimatica sono stati rispettivamente di 44,44% e 40,86%, ottenendo un buon effetto di immobilizzazione. Il prossimo articolo continuerà a presentare in dettaglio i diversi metodi di preparazione delle microsfere magnetiche di biopolimeri.
Contattateci ora!
Se avete bisogno di Price, inserite i vostri dati di contatto nel modulo sottostante; di solito vi contatteremo entro 24 ore. Potete anche inviarmi un'e-mail info@longchangchemical.com durante l'orario di lavoro (dalle 8:30 alle 18:00 UTC+8 lun.-sab.) o utilizzare la live chat del sito web per ottenere una risposta immediata.
| Composto Glucoamilasi | 9032-08-0 |
| Pullulanase | 9075-68-7 |
| Xilanasi | 37278-89-0 |
| Cellulasi | 9012-54-8 |
| Naringinasi | 9068-31-9 |
| β-amilasi | 9000-91-3 |
| Glucosio ossidasi | 9001-37-0 |
| alfa-amilasi | 9000-90-2 |
| Pectinasi | 9032-75-1 |
| Perossidasi | 9003-99-0 |
| Lipasi | 9001-62-1 |
| Catalasi | 9001-05-2 |
| TANNASIO | 9025-71-2 |
| Elastasi | 39445-21-1 |
| Ureasi | 9002-13-5 |
| DEXTRANASE | 9025-70-1 |
| L-lattico deidrogenasi | 9001-60-9 |
| Deidrogenasi malato | 9001-64-3 |
| Colesterolo ossidasi | 9028-76-6 |