20 mécanismes de réaction organique qu'il est essentiel de comprendre pour les expériences de synthèse
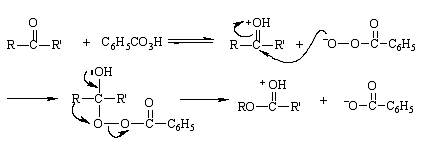
Mécanisme réactionnel de Baeyer-Villiger Le peracide subit d'abord une addition nucléophile sur le groupe carbonyle, puis un groupe hydrocarboné sur le groupe carbonyle de la cétone migre avec une paire d'électrons vers l'atome d'oxygène directement attaché à l'atome de carbone du groupe -O-O-, tandis que se produit une hétérolyse de la liaison O-O. Il s'agit donc d'une réaction de réarrangement, dans laquelle le groupe -O-O- est directement attaché à l'atome de carbone de la cétone. Il s'agit donc d'une réaction de réarrangement
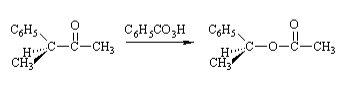
La réaction d'une 3-phénylbutanone optiquement active avec du peracide, où les baies des atomes de carbone chiraux des produits de réarrangement restent inchangées, indique que la réaction est un réarrangement intramoléculaire.
Lorsqu'une cétone asymétrique est oxydée, les deux groupes peuvent migrer lors de l'étape de réarrangement, mais il existe toujours une certaine sélectivité, dans l'ordre de leur capacité à migrer comme suit.
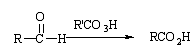
Le mécanisme d'oxydation de l'aldéhyde est similaire, mais la migration des ions négatifs de l'hydrogène donne l'acide carboxylique.