Magnetische Biopolymer-Mikrokugeln sind ein neuartiges Verbundmaterial, das biologische Materialien und anorganische magnetische Materialien kombiniert, um magnetisch ansprechende und biologisch aktive Mikrokugeln zu bilden. Ihre Eigenschaften hängen von den anorganischen magnetischen Materialien, den biologischen Materialien und der Art ihrer Wechselwirkung ab. Das derzeit am meisten verwendete und untersuchte magnetische Material ist Fe3O4 magnetischen Nanopartikeln. Aufgrund ihrer großen spezifischen Oberfläche, ihrer guten Biokompatibilität und ihrer hohen magnetischen Reaktion können sie eine schnelle Trennung und gezielte Bewegung erreichen, so dass sie in der Lebensmittelindustrie, der medizinischen Versorgung, dem Umweltschutz und anderen Bereichen weit verbreitet sein können. Zu den biopolymeren Materialien gehören hauptsächlich Chitosan, Natriumalginat, Gelatine usw. Chitosan ist das am meisten untersuchte biologische Material, da es sich durch gute Biokompatibilität, erneuerbare Ressourcen und biologische Abbaubarkeit auszeichnet. Ein neuartiger Verbundwerkstoff, der aus Chitosan und magnetischem Material besteht, hat beides hervorragende Eigenschaften, so dass er breite Anwendungsmöglichkeiten in verschiedenen Bereichen bietet.

1. Struktur und Eigenschaften von magnetischen Biopolymer-Mikrokugeln

Die Struktur der magnetischen Biopolymer-Mikrokugeln umfasst drei Arten: (1) Kern-Schale-Struktur; (2) Hybridstruktur; (3) mehrschichtige Sandwichstruktur, wie in Abbildung 1 dargestellt.
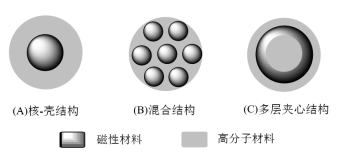
Abbildung 1: Struktur der magnetischen Biopolymer-Mikrokugeln

Magnetische Biopolymer-Mikrokugeln haben viele hervorragende Eigenschaften, die sie für die Immobilisierung von Enzymen besser geeignet machen. Zum Beispiel (1) Oberflächeneffekt. Wenn die Partikelgröße von magnetischen Biopolymer-Mikrokugeln den Mikrometer- oder sogar Nanometerbereich erreicht, erhöht sich im Allgemeinen mit zunehmender spezifischer Oberfläche auch die Gruppendichte und die selektive Adsorptionsleistung der Mikrokugeln, und die Stabilität der Mikrokugeln nimmt deutlich zu. (2) Magnetische Wirkung. Wenn der Durchmesser von Fe3O4 Kristall weniger als 30 nm groß ist, besitzt er einen Super-Paramagnetismus, d. h. der Magnetismus ist unter der Bedingung eines äußeren Magnetfeldes sehr groß. Wenn das äußere Magnetfeld entfernt wird, verschwindet der Magnetismus schnell, so dass die Mikrokugel unter der Bedingung eines äußeren Magnetfeldes eine magnetische Ausrichtung hat und sich schnell von nichtmagnetischen Materialien trennen kann. Sie wird in einem Magnetfeld nicht dauerhaft magnetisiert, so dass sie die spätere Verwendung nicht beeinträchtigt. (3) Biokompatibilität. In der Natur sind biologische Materialien wie Proteine und Polysaccharide biokompatibel, was ihnen wichtige Anwendungen in der Biomedizintechnik ermöglicht. (4) Funktionelle Basiseigenschaften. Biologische Materialien wie Chitosan und Natriumalginat verfügen über zahlreiche aktive Gruppen (-OH, -COOH, -NH2), die kovalent mit biologisch aktiven Substanzen verbunden oder mit bestimmten chemischen Gruppen modifiziert werden können.

2. Herstellung von magnetischen Biopolymer-Mikrokugeln

Die Herstellung von magnetischen Biopolymer-Mikrokugeln ist in zwei Schritte unterteilt. Der erste Schritt ist die Herstellung von magnetischen Nanopartikeln. Die derzeit verwendeten Methoden zur Herstellung von Fe3O4 Magnetische Nanopartikel werden hauptsächlich durch chemische Co-Fällung, thermische Zersetzung von Eisensalz, Mikroemulsion und hydrothermale Verfahren hergestellt. Die chemische Co-Fällungsmethode ist einfach und bequem zu handhaben und die am häufigsten verwendete Methode zur Herstellung. Das Prinzip der chemischen Co-Fällungsmethode zur Synthese von Fe3O4 ist die Synthese von Eisenoxid durch Erhitzen und Rühren einer gemischten Salzlösung mit einem bestimmten Anteil an Fe2+ und Fe3+ (1:2) unter anaeroben Bedingungen und schneller Zugabe von Lauge (Ammoniak oder NaOH). Xu et al. verwendeten die chemische Co-Fällungsmethode, um 4,34 mmol FeCl2鑘4H2O und 8,67 mmol FeCl3-6H2O, und erhitzen Sie das System unter Stickstoff auf 85 ℃. Nach dem vollständigen Auflösen gibt man schnell 25 mL konzentrierten Ammoniak und eine bestimmte Menge Natriumcitrat hinzu, dann wird das Fe3O4 magnetische Nanopartikel mit guter Mono-Dispersität und magnetischer Ansprechbarkeit synthetisiert.

Nach der Herstellung von magnetischen Nanopartikeln müssen diese mit Chitosan vernetzt werden, um magnetische Chitosan-Mikrokugeln herzustellen. Gegenwärtig umfassen die Synthesemethoden für magnetische Chitosan-Mikrokugeln hauptsächlich die Emulsionsvernetzungsmethode, die Sprühtrocknungsmethode, die photochemische Methode und die In-situ-Methode. Die Emulsionsvernetzungsmethode ist die einfachste und am weitesten verbreitete Methode. Bei der Emulsionsvernetzungsmethode wird das Fe3O4 oder magnetische Flüssigkeit in eine gemischte Flüssigkeit, die Chitosan, ein Tensid und eine Ölphase enthält, um ein Wasser-in-Öl-Mikroemulsionssystem zu bilden, und dann Glutaraldehyd hinzufügen; in dem System findet zwischen Glutaraldehyd und Chitosan eine Vernetzungsreaktion statt, um eine Schiffsbase zu erzeugen, und das Chitosan wird zu einem Netzwerk vernetzt und überzieht dann Fe3O4 (wie in Abbildung 2 dargestellt). Jiang et al. verwendeten die Emulsionsvernetzungsmethode unter Verwendung von Span 80, flüssigem Paraffin und Glutaraldehyd als Tensid, Dispergiermittel bzw. Vernetzungsmittel, um magnetische Chitosan-Mikrokugeln mit regelmäßiger Kugelform und glatter Oberfläche zu synthetisieren.
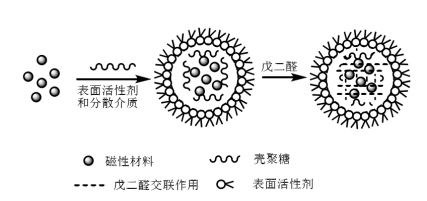
Abbildung 2 Schematische Darstellung der Synthese von magnetischen Chitosan-Mikrokugeln durch Emulsionsvernetzung

3. Auf magnetischen Verbundmikrokugeln immobilisiertes Enzym

Nachdem die magnetischen Chitosan-Mikrokugeln erfolgreich hergestellt wurden, kann das Enzym auf den Mikrokugeln immobilisiert und verwendet werden. Da Chitosan reich an aktiven Aminogruppen und Hydroxylgruppen ist, kann es mit Carboxylgruppen, Aminogruppen, Epoxygruppen, bifunktionellen Gruppen usw. reagieren. Die magnetischen Chitosan-Mikrokugeln sind gruppenmodifiziert, um den Anforderungen unterschiedlicher Immobilisierung gerecht zu werden. Die Zubereitungsmethoden für spezifische immobilisierte Enzyme werden im Folgenden nach funktionellen Gruppen vorgestellt.

1) Auf carboxylmodifizierten magnetischen Verbundmikrokugeln immobilisiertes Enzym
Die carboxylmodifizierten magnetischen Verbundmikrokugeln können kovalent an die Aminogruppe des Enzyms gebunden werden, nachdem sie durch Carbodiimid-Kopplung in einer wässrigen Lösung aktiviert wurden, wodurch das Enzymmolekül an den magnetischen Verbundmikrokugeln immobilisiert wird (Abbildung 3). Zhu Yihua und andere verwendeten eine verbesserte Suspensionspolymerisationsmethode, um die mit Styrol behandelte magnetische Flüssigkeit und das Monomer Methylacrylat durch das vernetzende Monomer Divinylbenzol zu copolymerisieren, und verwenden dann Alkalihydrolyse, um einen magnetischen Verbundstoff mit guter Monodispersität und reichen Carboxylgruppen zu erhalten. Die Mikrokugeln werden zur Immobilisierung von Laktase verwendet, nachdem sie durch Carbodiimid-Kopplung aktiviert wurden. Die höchste Aktivität beträgt etwa 360 U-g-1und die Vernetzungseffizienz des Enzyms beträgt etwa 20%.
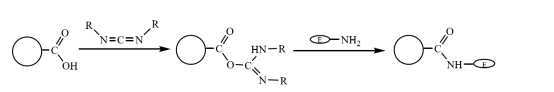
Abbildung 3 Schematische Darstellung der Herstellung von immobilisierten Enzymen auf carboxylmodifizierten magnetischen Verbundmikrokugeln

2) Aminomodifizierte magnetische Verbundmikrokugeln mit immobilisiertem Enzym
Nachdem die aminomodifizierten magnetischen Verbundmikrokugeln mit einer geeigneten Menge Glutaraldehyd gekoppelt und aktiviert wurden, können sie kovalent an die Aminogruppe des Enzyms binden, wodurch die Enzymmoleküle auf den magnetischen Mikrokugeln immobilisiert werden (Abbildung 4). Liu Yu et al. stellten nacheinander monodisperse magnetische SiO2 Partikel durch chemische Co-Präzipitation Methode und Sol-Gel-Methode, modifiziert sie mit Aminogruppen durch Silan-Kopplungsmittel, und immobilisiert Laccase mit Glutaraldehyd als das Vernetzungsmittel. Die Ergebnisse zeigten, dass die immobilisierte Laccase bei einer konstanten Temperatur von 60 ℃ für 4 Stunden gehalten wurde und immer noch 60,9% Enzymaktivität hatte, und nach 10 Zyklen der Verwendung, hatte es immer noch mehr als 55% Enzymaktivität, und seine thermische Stabilität und Betriebsstabilität wurden deutlich verbessert.
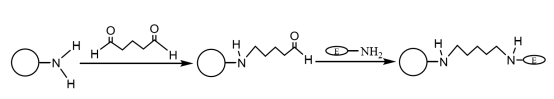
Abbildung 4 Schematische Darstellung der Herstellung von immobilisierten Enzymen auf aminomodifizierten magnetischen Verbundmikrokugeln
3) Epoxid-modifizierte magnetische Verbundmikrokugeln mit immobilisiertem Enzym
Die Epoxidgruppe ist eine äußerst aktive Gruppe. Sie kann ohne Modifikation direkt kovalent an biologische Gruppen gebunden werden. Daher werden die Moleküle nach der kovalenten Bindung der mit Epoxy modifizierten magnetischen Verbundmikrokugeln an die Aminogruppe des Enzyms auf den magnetischen Mikrokugeln immobilisiert (Abbildung 5). Yong et al. stellten ölsäurebeschichtete magnetische Mikrokugeln durch Suspensionspolymerisation her. Die nach der Aktivierung mit Methanol erhaltenen hydrophilen magnetischen Mikrokugeln auf Epoxidbasis wurden für die Immobilisierung von Lipase verwendet. Die Retentionsrate der immobilisierten Enzymaktivität beträgt 64,2%, und ihre Stabilität ist deutlich verbessert.
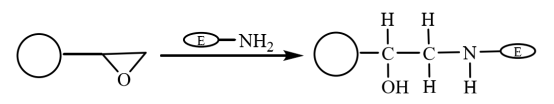
Abbildung 5 Schematische Darstellung der Herstellung von immobilisierten Enzymen auf magnetischen Verbundmikrokugeln auf Epoxidbasis

4) Enzyme, die auf magnetischen Komposit-Mikrokugeln immobilisiert sind, die mit bifunktionellen Gruppen modifiziert wurden

Auf den bifunktionalen magnetischen Mikrokugeln werden zunächst die Carboxylgruppen des Enzymmoleküls und die Aminogruppen auf den Mikrokugeln durch Ioneninteraktion schnell auf dem Träger immobilisiert, und das durch Ioneninteraktion immobilisierte Enzym interagiert über seine Sulfhydryl- und Aminogruppen kovalent mit den Epoxygruppen auf dem Träger. Dadurch wird es weiter fixiert (wie in Abbildung 6 dargestellt), was die beiden Eigenschaften der schnellen Fixierung durch Ionenwirkung und der festen Fixierung durch kovalente Bindung aufweist. Li Xiutao et al. brachten drei zufällige Copolymerbürsten auf der Oberfläche von mit Divinylbenzol vernetzten Polyacrylsäure-Mikrokugeln mit Fe3O4 Nanopartikeln dispergiert und dann zur Immobilisierung von Penicillin-G-Acylase verwendet. Die Ergebnisse zeigen, dass die Aktivität und Wiederherstellungsrate der Enzymaktivität des immobilisierten Enzyms mit beiden Epoxy-Gruppe und Amino-Gruppe zur gleichen Zeit eingeführt sind die höchsten, seine Immobilisierung Kinetik ist besser als die von nur Epoxy-enthaltenden magnetischen Mikrokugeln, und seine optimale pH-Wert und Temperatur Stabilität Es ist höher als freies Enzym, und seine Enzymaktivität behält 70% nach wiederholter Verwendung für 10 mal.
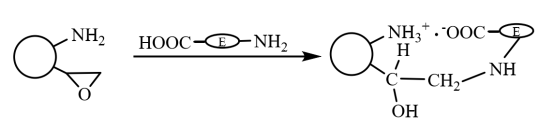
Abbildung 6 Schematische Darstellung der Herstellung von immobilisierten Enzymen auf magnetischen Verbundmikrokugeln, die mit bifunktionellen Gruppen modifiziert wurden

In den letzten Jahren haben Wissenschaftler zwar verschiedene Materialien zur Immobilisierung von Naringinase verwendet, z. B. natürliche Biopolymere wie Chitosan, Natriumalginat und Seidenprotein, organische Verbindungen wie Epoxidharz und Polyvinylalkohol, Aktivkohle und Graphitoxid-Kohlenstoffmaterialien wie Ene, und es wurden bestimmte Forschungsergebnisse erzielt, aber bei der tatsächlichen Entbitterung gibt es Probleme wie schlechte Säurebeständigkeit der immobilisierten Enzyme, langsame Abtrennung vom Saft oder unvollständige Abtrennung usw. In Bezug auf die oben genannten Probleme wird im nächsten Artikel eine Forschungsarbeit im Detail vorgestellt. In diesem Wok verwendeten die Forscher ein Verbundmaterial aus Chitosan, magnetischem Fe3O4 Nanopartikeln und Siliziumdioxid, modifizierte das Verbundmaterial mit Epoxidgruppen und immobilisierte dann Naringinase darauf. Diese Arbeit liefert die Datengrundlage für weitere Studien zur Immobilisierungstechnologie von Naringinase.
Kontaktieren Sie uns jetzt!
Wenn Sie einen Preis benötigen, tragen Sie bitte Ihre Kontaktdaten in das unten stehende Formular ein. Wir werden uns in der Regel innerhalb von 24 Stunden mit Ihnen in Verbindung setzen. Sie können mir auch mailen info@longchangchemical.com während der Geschäftszeiten ( 8:30 bis 18:00 Uhr UTC+8 Mo.~Sa. ) oder nutzen Sie den Live-Chat auf der Website, um eine schnelle Antwort zu erhalten.
| Verbindung Glucoamylase | 9032-08-0 |
| Pullulanase | 9075-68-7 |
| Xylanase | 37278-89-0 |
| Cellulase | 9012-54-8 |
| Naringinase | 9068-31-9 |
| β-Amylase | 9000-91-3 |
| Glukose-Oxidase | 9001-37-0 |
| alpha-Amylase | 9000-90-2 |
| Pektinase | 9032-75-1 |
| Peroxidase | 9003-99-0 |
| Lipase | 9001-62-1 |
| Katalase | 9001-05-2 |
| TANNASE | 9025-71-2 |
| Elastase | 39445-21-1 |
| Urease | 9002-13-5 |
| DEXTRANASE | 9025-70-1 |
| L-Milch-Dehydrogenase | 9001-60-9 |
| Dehydrogenase Malat | 9001-64-3 |
| Cholesterin-Oxidase | 9028-76-6 |
