PVC ist eines der am häufigsten verwendeten Polymere auf dem Markt heute, und es spielt eine wichtige Rolle in den Bereichen Baumaterialien und elektronische Verpackungen. Allerdings PVC in den externen Faktoren (wie Wärme, Sauerstoff, Licht und Kraft, etc.) unter der Wirkung der Zersetzung und Vernetzung Reaktion, was zu PVC-Produkte Verfärbung, Schwächung der mechanischen Eigenschaften.PVC erhitzt auf 110 ℃ wird HCl-Gas freisetzen, so dass PVC begann zu zersetzen. Derzeit sind PVC-Wärmestabilisatoren hauptsächlich fünf Arten: Bleisalz-Wärmestabilisatoren, Metallseifen-Wärmestabilisatoren, Organozinn-Wärmestabilisatoren, organische Wärmestabilisatoren und Seltenerd-Wärmestabilisatoren. Wegen der Schwermetalle in den Blei-Salz-Wärmestabilisatoren und der damit verbundenen Umweltverschmutzung werden sie nur noch selten verwendet. Metall-Seife Art Wärmestabilisatoren zunächst schlechte Anti-Farb-Fähigkeit, PVC-Abbau von instabilen Chloratom Substitutionsfähigkeit ist schlecht, um die Marktnachfrage zu erfüllen. Organische Zinn-Hitzestabilisatoren haben eine erhebliche stabilisierende Wirkung, aber einige von ihnen sind giftig und teuer, was ihre Entwicklung einschränkt. Organische Wärmestabilisatoren sind ungiftig und umweltfreundlich, aber die Stabilität von PVC-Wärmestabilisatoren allein ist schlecht. Wärmestabilisatoren auf der Basis von Seltenen Erden, die sich durch geringe Toxizität, Umweltfreundlichkeit und gute thermische Stabilität auszeichnen, sind stärker untersucht worden.
Mit der Entwicklung und Innovation von Wissenschaft und Technik ist der Umweltschutz zu einem wichtigen Kriterium für Wärmestabilisatoren geworden, so dass stickstoffhaltige heterozyklische Carbonsäuren als Wärmestabilisatoren große Beachtung gefunden haben. Dies liegt daran, dass die Hitzestabilisatoren keine Schwermetalle enthalten, wodurch das Problem der Umweltverschmutzung gelöst wird, und dass sie außerdem ein ausgezeichneter Ligand mit guter thermischer Stabilität sind. Durch die Kombination von stickstoffhaltigen heterozyklischen Carbonsäure-Wärmestabilisatoren mit Seltenerd-Salzlösungen kann eine neue Art von stickstoffhaltigen heterozyklischen Carbonsäure-Seltenerd-Wärmestabilisatoren synthetisiert werden. Seine Vorteile sind geringe Toxizität, Umweltschutz, gute Lichtdurchlässigkeit, gute thermische Stabilität, niedrige Kosten, hohe Ausbeute und hohes Entwicklungspotenzial. Liu Zhaogang et al. verwendeten Imidazol-4,5-Dicarbonsäure, Natriumhydroxid und Lanthanchlorid als Rohstoffe zur Herstellung eines stickstoffhaltigen heterozyklischen Seltenerd-Wärmestabilisators und führten anschließend statische Wärmestabilisierungsexperimente und dynamische Wärmestabilisierungsexperimente durch, wobei sie feststellten, dass der Herstellungsprozess relativ mühsam und die Reaktionszeit relativ lang ist, das Produkt jedoch eine gute thermische Stabilität aufweist. Zhang Ning und andere synthetisierten 8 Arten von Lanthan-Aminosäure-Wärmestabilisatoren mit Aminosäuren, Natriumhydroxid und Lanthannitrat als Rohstoffen und führten weitere Untersuchungen durch statische Wärmestabilisierungsexperimente und dynamische Wärmestabilisierungsexperimente durch und verglichen die Wärmestabilität von 8 Arten von Lanthan-Aminosäuren, und stellten fest, dass die 8 Arten von Lanthan-Aminosäuren Benzolring und Schwefel enthielten, was giftig und nicht umweltfreundlich war, und dass Tryptophan unter den 8 Arten von Aminosäure-Rohstoffen Benzolring enthielt, aber die Hitzestabilität von Lanthan-Tryptophan war besser als die von 8 Arten von Aminosäuren, und die Hitzestabilität von Lanthan-Tryptophan war besser als die von 8 Arten von Aminosäuren. Die Wärmestabilität von Lanthantryptophan ist jedoch die beste unter den 8 Arten von Lanthanaminosäuren, und die Aktivierungsenergie des zusammengesetzten Wärmestabilisators ist besser als die des Lanthantryptophanmonomers und der handelsüblichen Calcium- und Zinkwärmestabilisatoren, was die Wärmestabilität von PVC verbessern kann.
In dieser Arbeit wurde 2,3⁃PDA als Ligand des Elements Lanthan bei pH=6~7 synthetisiert. 2,3⁃LPDA wurde als Hauptwärmestabilisator von PVC für die Untersuchung der Wärmestabilität verwendet, und dann wurde es mit zusätzlichen Wärmestabilisatoren wie Calciumstearat, Zinkstearat, Pentaerythrit usw. gemischt, und die Hitzestabilität des zusammengesetzten Systems wurde vergleichend mit der von 2,3⁃LPDA und der thermischen Stabilisierung des Teils des Hitzestabilisators analysiert. Die Auswirkungen einiger Hitzestabilisatoren auf die Plastifizierung und die mechanischen Eigenschaften von PVC wurden charakterisiert; schließlich wurde der Hitzestabilisierungsmechanismus von 2,3⁃LPDA untersucht.
1
Vorbereitung der Probe
2,3⁃LPDA-Herstellung: Wiegen Sie die entsprechende Menge an Lanthanoxid in ein Becherglas, fügen Sie entionisiertes Wasser und gut umrühren; setzen Sie das Becherglas in die 60 ℃ Wasserbad Heizung, Rühren der Lanthanoxid wässrige Lösung mit einem Rührer, und dann verwenden Sie die Pipette, um langsam Salpetersäure-Lösung, um die Lösung von Lanthanoxid ist vollständig aufgelöst; der pH-Wert der Lösung wurde bestimmt, um 3 ~ 4 von pH-Papier für die Filtration, das Filtrat für die Lösung von Lanthannitrat erhalten, und goss in eine Reagenz Flasche für Ersatz, und seine molaren Wert war 0.015 mg/L. Die Lösung wurde filtriert und dann in eine Reagenzflasche gegossen. Die molare Konzentration der Reagenzienflasche wurde durch EDTA-Titration bestimmt, wobei das molare Verhältnis von 3:2 2,3 ⁃ PDA und Lanthannitrat, die erste wasserfreie Ethanol wird 2,3 ⁃ PDA Pulver gelöst, und dann verdünnen Ammoniak, um den pH-Wert auf 6 ~ 7, unter ständigem Rühren der Lanthannitratlösung wird langsam zu der wasserfreien Ethanollösung von 2,3 ⁃ PDA hinzugefügt, und dann verdünnter Ammoniak, um den pH-Wert des Systems auf 6 ~ 7 einzustellen, was zu einem weißen Niederschlag führt, mit einem elektrischen Rührer. Weißer Niederschlag, gerührt mit einem elektrischen Rührer für 3 h, um das System vollständig reaktiv zu machen, und dann links, um den Niederschlag zu lassen alle ausgefallen, und dann filtriert, und dann wusch den Niederschlag mit wasserfreiem Ethanol für mehrere Male; der Verbund wurde bei 50 ℃ auf ein konstantes Gewicht getrocknet, und das resultierende Produkt war 2,3 ⁃ LPDA Seltene-Erden-Wärme-Stabilisatoren, und dann wurde das Produkt in ein Pulver gemahlen und dann in einen Beutel für Ersatz Verwendung verpackt;
Compound Wärmestabilisator Vorbereitung: 2,3 ⁃ LPDA mit Zinkstearat und Pentaerythritol nach verschiedenen Massenverhältnis der binären und ternären Compoundierung, Wiegen, Mahlen und Mischen des Pulvers, Beuteln Ersatz.
2
Ergebnisse und Diskussion
2.1 Charakterisierung von 2,3⁃LPDA
2.1.1 Spektralanalyse im Infrarotbereich
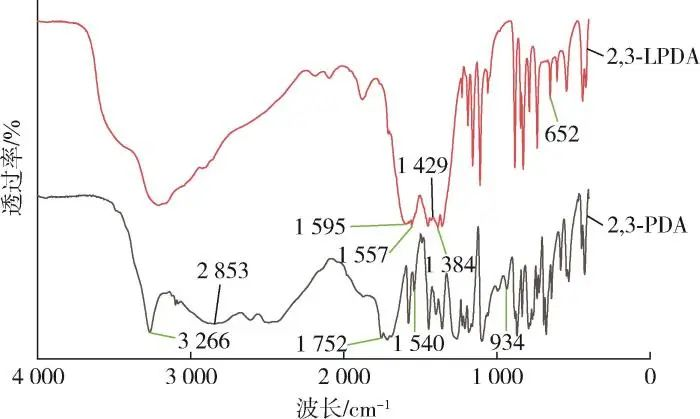
Abbildung 1 zeigt die FTIR-Spektren von 2,3⁃PDA und 2,3⁃LPDA. Es ist zu erkennen, dass die teleskopischen Schwingungspeaks der C=N-Bindung in 2,3⁃PDA und 2,3⁃LPDA bei 1.540 cm-1 bzw. 1.557 cm-1 liegen; die teleskopischen Schwingungspeaks von NO3- auf 2,3⁃LPDA bei 1.384 cm-1 ; die teleskopischen Schwingungspeaks der C=O-Bindung auf 2,3⁃PDA bei 1,752 cm-1 ; die teleskopischen Schwingungspeaks der C=O-Bindung auf 2,3⁃PDA bei 1,595 cm-1 bzw. 1,429 cm-1 ; die teleskopischen Schwingungspeaks von 2,3⁃PDA auf 2,3 ⁃PDA bei 1,595 cm-1 bzw. 1,429 cm-1 . Bei 1.595 cm-1 und 1.429 cm-1 handelt es sich um die antisymmetrischen bzw. symmetrischen Teleskopschwingungspeaks der C=O-Bindung auf 2,3⁃LPDA; 3.266 cm-1 ist der Teleskopschwingungspeak der O-H-Bindung auf 2,3⁃PDA; und 934 cm-1 ist der charakteristisch breite Peak von -COOH auf 2,3⁃PDA, der es uns erlaubt, das Vorhandensein von Carboxylatgruppen festzustellen; Der Streckschwingungspeak der O-La-Bindung auf 2,3⁃LPDA bei 652 cm-1, was darauf hindeutet, dass die Reaktion von 2,3⁃PDA mit Lanthannitrat als Ligand die O-H-Bindung in der Carboxylatgruppe auf 2,3⁃PDA dazu veranlasst hat, die Kette zu brechen und de-H zu bilden, und eine O-La-Bindung mit dem La-Ion gebildet hat. Zusammenfassend kann festgestellt werden, dass durch die Reaktion 2,3⁃LPDA entstanden ist.
Abbildung 1 FTIR-Spektrum der Probe
2.1.2 Elementare und thermische Analyse
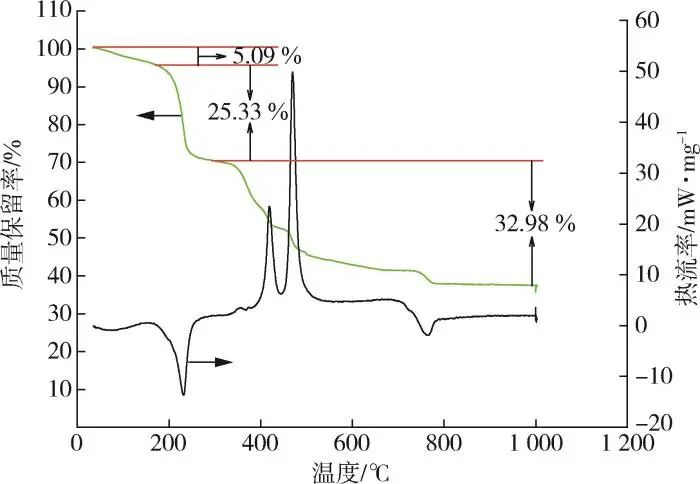
Der Elementgehalt von C, H und N in 2,3⁃LPDA wurde durch Elementaranalyse bestimmt, und der Lanthangehalt wurde durch EDTA-Titration ermittelt. Aus Tabelle 1 ist ersichtlich, dass der relative Fehler des H-Gehalts (Massenanteil, siehe unten) aufgrund seiner geringen Menge groß ist und der tatsächliche Gehalt der anderen Elemente im Wesentlichen mit dem theoretischen Gehalt übereinstimmt. Dann wurde die Anzahl der Kristallwasser durch die Ergebnisse der thermischen Analyse in Abb. 2 berechnet, was zu der Molekularformel von 2,3⁃LPDA als La2(C6N2O4)2(NO3)2-3H2O führte. Aus den TG-Kurven in Abb. 2 ist ersichtlich, dass der thermische Gewichtsverlust von 2,3⁃LPDA in drei Phasen unterteilt war, und zwar in die Phasen von 50 bis 184, 184 bis 292 bzw. 292 bis 1.000 ℃. Die Massenverlustrate der ersten Stufe betrug 5,09 %, und aus der Massenverlustrate wurde abgeleitet, dass es drei kristalline Wässer gab, was der 6.88 % kristallines Wasser in der Molekülformel La2(C6N2O4)2(NO3)2-3H2O, wie aus Tabelle 1 abgeleitet; die DSC-Kurve der ersten Stufe hatte einen Wärmeabsorptionspeak bei 87,1~140,6 ℃, was die Entfernung von kristallinem Wasser aus 2,3 ⁃LPDA darstellt. Aus den TG-Kurven der zweiten und dritten Stufe ist ersichtlich, dass 2,3 ⁃LPDA einen steilen Gewichtsverlust aufweist, mit einem Gesamtmassenverlust von 58,31% in der zweiten und dritten Stufe; im Gegensatz zu den DSC-Kurven gab es in der zweiten Stufe einen inspirierenden Peak bei 184~292,4 ℃, der die Zersetzung des Produkts darstellt. In der dritten Stufe erschienen zwei exotherme Peaks, die die weitere Zersetzung der Produkte darstellten. Nach 797 ℃ gab es keinen weiteren Gewichtsverlust mehr, und die TG-Kurve neigt dazu, abzuflachen, und der endgültige Rückstand ist La2O3, das 36,59% des Massenanteils ausmacht, und der La-Gehalt wird auf 31,11% berechnet, was dem theoretischen La-Gehalt von 31,53% in Tabelle 1 entspricht. Zusammenfassend lässt sich sagen, dass die Molekülformel des Wärmestabilisators aus Seltenen Erden durch Vergleich der Daten in Tabelle 1 und Abbildung 2 als La2(C6N2O4)2(NO3)2-3H2O bestimmt wurde.
Tabelle 1 Ergebnisse der Elementaranalyse von 2,3⁃LPDA
Abb. 2 Thermische Analysekurve von 2,3⁃LPDA
2.2 Analyse der thermischen Stabilität
2.2.1 Einfacher thermischer Stabilisator
Um die thermische Stabilität von 2,3⁃LPDA eingehender zu untersuchen, wurde seine thermische Stabilität mit der gängiger thermischer Stabilisatoren verglichen, und die Ergebnisse sind in Tabelle 2 dargestellt. Aus Tabelle 2 ist ersichtlich, dass die thermische Stabilisierungszeit von 2,3⁃LPDA 30 Minuten beträgt, was 6-mal länger ist als die von 2,3⁃PDA, nur kürzer als die von Bleistearat und länger als die von anderen Wärmestabilisatoren in der Tabelle. In Bezug auf die Verfärbungsschutzleistung hat 2,3⁃LPDA eine bessere anfängliche Verfärbungsschutzleistung als 2,3⁃PDA, was darauf hinweist, dass 2,3⁃LPDA eine stärkere Bindungsfähigkeit mit instabilem Cl- hat und die anfängliche Verfärbungsschutzleistung von PVC verbessert. In Bezug auf den langfristigen Verfärbungsschutz ist 2,3⁃LPDA ein wenig schwächer als Calciumstearat und Pentaerythritol. Mit Ausnahme von Calciumstearat und Pentaerythrit hat 2,3⁃LPDA einige Vorteile gegenüber anderen Hitzestabilisatoren in Bezug auf die Antiverfärbungsleistung und wirkt sich positiv auf die Verhinderung der thermischen Degradation von PVC aus.
Tabelle 2 Thermische Stabilität verschiedener Hitzestabilisatoren
2.2.2 2,3⁃LPDA in Verbindung mit Zinkstearat
Die anfängliche Verfärbungsbeständigkeit von 2,3⁃LPDA ist etwas schlechter als die von Zinkstearat, aber seine thermische Stabilisierungszeit und langfristige Verfärbungsbeständigkeit sind viel besser als die von Zinkstearat. Die Ergebnisse der Thermostabilitätstests für die beiden Komplexe sind in Tabelle 3 dargestellt. Aus Tabelle 3 ist ersichtlich, dass die längste thermische Stabilitätszeit 34 Minuten betrug, wenn das Mischungsverhältnis von 2,3⁃LPDA und Zinkstearat 4:1 betrug, und sie war länger als diejenige, wenn 2,3⁃LPDA allein als thermischer Stabilisator verwendet wurde, und je größer der Anteil von 2,3⁃LPDA im Mischungsverhältnis, desto länger die thermische Stabilitätszeit. Dies liegt daran, dass Re3+ und Cl- starke Koordinationseffekte haben und sich leichter mit dem durch Hitze zersetzten Cl- koordinieren. Die anfängliche Antiverfärbungsleistung der zusammengesetzten Hitzestabilisatoren wurde stark verbessert. Dies liegt daran, dass 2,3 ⁃ LPDA anfängliche Hemmung von Zinkstearat zu produzieren "Zink brennen" Phänomen ist offensichtlich, und es gibt einen starken synergistischen Effekt, die Verbindung der anfänglichen Anti-Farb-Leistung von PVC wurde stark verbessert. Allerdings, von der langfristigen Anti-Verfärbung Leistung, 2,3 ⁃ LPDA allein ist besser als die Compoundierung Anti-Verfärbung Leistung, und 2,3 ⁃ LPDA in der Compoundierung Verhältnis der kleineren Anteil, der "Zink brennen" Phänomen wird mehr offensichtlich, desto schlechter die langfristige Anti-Verfärbung, je kürzer die Hitzestabilisierungszeit, was darauf hinweist, dass je mehr der Anteil von Zinkstearat im Mischungsverhältnis, desto mehr der Anteil von 2,3 ⁃ LPDA und Zinkstearat, und je mehr der Anteil von 2,3 ⁃ LPDA und Zinkstearat, desto mehr der Anteil von 2,3 ⁃ LPDA und Zinkstearat. Je kürzer die Hitzestabilisierungszeit, was darauf hindeutet, dass der synergistische Effekt zwischen LPDA und Zinkstearat umso schlechter ist, je größer der Anteil von Zinkstearat im Mischungsverhältnis ist.
Tabelle 3 Thermische Stabilität von Zinkstearat-Verbundsystemen
2.2.3 Zusammenstellung von 2,3⁃LPDA mit Pentaerythritol
Pentaerythrit ist ein zusätzlicher Wärmestabilisator mit hervorragender thermischer Stabilität, und seine kurz- und langfristige Antiverfärbungsleistung ist gut. 2,3⁃LPDA und Pentaerythritol komplexiert mit der thermischen Stabilität ist in Tabelle 4 dargestellt. Aus der Tabelle ist ersichtlich, dass die thermische Stabilitätszeit der beiden komplexierten Hitzestabilisatoren im Bereich von 31-34 Minuten liegt, während die thermische Stabilitätszeit von 2,3 ⁃LPDA als alleinigem Hitzestabilisator 30 Minuten betrug, was darauf hindeutet, dass die thermische Stabilitätszeit von 2,3 ⁃LPDA mit Pentaerythritol, das mit Zinkstearat komplexiert ist, 30 Minuten beträgt, was darauf hindeutet, dass der synergistische Effekt zwischen 2,3 ⁃LPDA und Zinkstearat immer wichtiger wird. Die Hitzestabilisierungswirkung von 3⁃LPDA und Pentaerythritol ist nicht offensichtlich, die Hitzestabilisierungszeit wird nur um 1-3 Minuten verlängert, hat aber auch einen gewissen Synergieeffekt. Hinsichtlich der Verfärbungshemmung ist die Wirkung von Pentaerythrit sehr deutlich, und die anfängliche Verfärbungshemmung der beiden Komposite ist besser als die von 2,3⁃LPDA allein als Hitzestabilisator. Je höher der Anteil von Pentaerythrit im Wärmestabilisator ist, desto besser ist die Langzeit-Antifarbwirkung, was darauf hindeutet, dass die Verbindung von Pentaerythrit und 2,3⁃LPDA eine gute Antifarbwirkung hat und Pentaerythrit die Langzeit-Antifarbwirkung von 2,3⁃LPDA weiter erhöht. Insgesamt ist die hitzestabilisierende Wirkung von Pentaerythrit nicht offensichtlich, aber die Anti-Verfärbungseigenschaft ist sehr ausgeprägt. Dies ist auf die Fähigkeit des Alkohols zurückzuführen, die Färbung von PVC beim Erhitzen zu verändern, und mit steigender Temperatur verestert der Alkohol, wodurch es für den Alkohol schwieriger wird, aus dem PVC auszufallen. Gleichzeitig können Pentaerythrit und Lanthan komplexiert werden, um die während des Abbaus von PVC gebrochenen Ketten in der Molekülkette auszugleichen und so die langfristige Fähigkeit von PVC zur Verhinderung von Farbveränderungen zu verstärken.
Tabelle 4 Thermische Stabilität des Pentaerythrit-Komplex-Systems
2.2.4 Zusammenstellung von 2,3⁃LPDA, Zinkstearat und Pentaerythritol
Das Phänomen der "Zinkverbrennung", das durch Zinkstearat verursacht wird, kann durch Pentaerythritol verzögert werden. Um die Hitzestabilisatoren mit einer ausgezeichneten Antifarbveränderungsfähigkeit und Hitzestabilisierungszeit auszustatten, wurden 2,3⁃LPDA, Zinkstearat und Pentaerythrit zusammengesetzt, und ihre Hitzestabilität ist in Tabelle 5 dargestellt. Wie aus Tabelle 5 ersichtlich, betrug die thermische Stabilisierungszeit bei einem Verhältnis von 2,3⁃LPDA:Zinkstearat:Pentaerythritol von 2:1:2 44 Minuten, was höher war als bei den anderen beiden Mischungsverhältnissen, was beweist, dass es einen starken synergistischen Effekt gab, wenn 2,3⁃LPDA und Pentaerythritol den gleichen Anteil ausmachten. Aus der Sicht der Antiverfärbungsleistung wurde durch den Zusatz von Pentaerythritol die Antiverfärbung des zusammengesetzten Systems erheblich verbessert, und Pentaerythritol verlangsamte auch das Auftreten des Phänomens der Zinkstearat-"Zinkverbrennungen", die langfristige Antiverfärbung des Systems nach den drei Zusammensetzungen wurde erheblich verbessert. Ein Vergleich von Tabelle 2, Tabelle 3 und Tabelle 5 zeigt, dass die Verfärbungshemmung des ternären Mischsystems deutlich besser ist als die des binären Mischsystems. Dies liegt daran, dass die zusätzlichen Hitzestabilisatoren der Polyole bis zu einem gewissen Grad das Auftreten des Zinkstearat-"Zinkverbrennungs"-Phänomens verhindern können, und dass der durch die Reaktion zwischen Pentaerythrit und Zinkstearat erzeugte Komplex die katalytische Wirkung von ZnCl2 auf den Abbau von PVC wirksam schwächen kann.
Tabelle 5 Thermische Stabilität des ternären Mischsystems
2.3 Analyse der Plastifizierungseigenschaften
In dieser Studie wurden Plastifizierungsexperimente mit verschiedenen Hitzestabilisatoren durchgeführt, um die Wirkung von Hitzestabilisatoren auf die dynamische thermische Stabilität von PVC zu untersuchen; die Ergebnisse sind in Tabelle 6 aufgeführt. Wie aus der Tabelle ersichtlich ist, war die Plastifizierungszeit der Wärmestabilisatorprobe, die Zinkstearat in Verbindung mit 2,3⁃LPDA enthielt, am längsten. Dies liegt daran, dass Zinkstearat allein Plastifizierung, Plastifizierung Leistung ist sehr schlecht, am Ende der Aufladung, wird sofort erscheinen "Zink brennen" Phänomen, das Phänomen wird den Abbau von PVC zu fördern, kann nicht die Plastifizierung zu realisieren; und mit 2,3 ⁃ LPDA-Komplex, 2,3 ⁃ LPDA spielte eine Rolle bei der Verlangsamung der "Zink brennen" Phänomen, die Wirkung der "Zink brennen" Phänomen, die Wirkung der "Zink brennen" Phänomen. "Nach dem Höhepunkt der Plastifizierung begann Zinkstearat, den Abbau von PVC zu fördern, was zu einer beschleunigten Zersetzung des PVC-Pulvers führte. Obwohl die Plastifizierungszeit der Probe, die den ternären Hitzestabilisator enthält, etwas länger ist als die der Probe, die 2,3 ⁃LPDA enthält, sind das Plastifizierungsmoment und das Gleichgewichtsmoment niedriger, was darauf hindeutet, dass es die Adhäsion zwischen PVC und den Verarbeitungsmaschinen während des Prozesses verringern kann, wodurch der Energieverlust und der Stromverbrauch reduziert werden.
Tabelle 6 Plastifizierungseigenschaften der verschiedenen Proben
2.4 Analyse der Festigkeitseigenschaften
Entsprechend den Ergebnissen der statischen Wärmestabilisierungsexperimente wurden die Wärmestabilisatoren der Seltenen Erden mit der besten Wärmestabilisierungsleistung in jeder Versuchsgruppe für den Test der Zugeigenschaften ausgewählt, um die Auswirkungen der verschiedenen Wärmestabilisatoren auf die Zugeigenschaften von PVC zu untersuchen; die Ergebnisse sind in Tabelle 7 dargestellt. Die Ergebnisse sind in Tabelle 7 dargestellt. Aus der Tabelle ist ersichtlich, dass sich die Zugeigenschaften von PVC durch den Zusatz von 2,3⁃LPDA zu PVC deutlich verbessert haben; Der Unterschied in den Zugeigenschaften zwischen den Wärmestabilisatorproben, die 2,3⁃LPDA und Zinkstearat enthielten, und den Zugeigenschaften der Proben, die 2,3 ⁃LPDA enthielten, war groß, was darauf zurückzuführen sein könnte, dass ein Teil des Zinkstearats bei der Vermischung mit der PVC-Folie das Phänomen des "verbrannten Zinks" zu zeigen schien, was den Abbau von PVC förderte. Dies kann auf das Phänomen des "Zinkverbrennens" einiger Zinkstearate während des Mischens von PVC-Flocken zurückzuführen sein, das den Abbau von PVC fördert und die Zugfestigkeit von PVC-Flocken verringert, was zu den schlechten mechanischen Eigenschaften von PVC-Flocken führt. Die letzten Daten in Tabelle 7 zeigen, dass 2,3⁃LPDA, Zinkstearat und Pentaerythrit die beste Wirkung auf die Erhöhung der PVC-Zugfestigkeit haben. Dies kann darauf zurückzuführen sein, dass die Seltenen Erden viele leere Orbitale haben, um das einsame Elektron des Liganden zu akzeptieren, während die Seltenen Erden-Metallionen einen großen Ionenradius haben, so dass sie und die organischen und anorganischen Substanzen in der PVC-Formel eine Vielzahl von Liganden oder Chelaten bilden, die Erhöhung der intermolekularen Wechselwirkungskraft, die PVC spielte eine weichmachende Wirkung, und verbessern die Zugfestigkeit von PVC-Materialien.
Tabelle 7 Mechanische Eigenschaften der verschiedenen Proben
2.5 Mechanismus der Hitzestabilisierung
Die FTIR-Spektren von 2,3⁃LPDA vor und nach der HCl-Behandlung sind in Abb. 3 dargestellt. Aus der Abbildung ist ersichtlich, dass sich in den FTIR-Spektren von 2,3⁃LPDA nach der HCl-Behandlung die Wellenzahl der C=N-Bindung im Vergleich zur unbehandelten Bindung von einer niedrigen zu einer hohen Wellenzahl verschoben hat und die Wellenzahl der C=N-Bindung nach der Behandlung 1.572 cm-1 beträgt. Darüber hinaus verschwand der teleskopische Schwingungspeak von NO3- nach der Behandlung mit HCl aus den Kurven, was darauf zurückzuführen ist, dass sich H+ mit NO3- zu HNO3 verbindet. Aufgrund der Kombination von H+ und NO3- zur Bildung von HNO3 bei der Behandlung von 2,3⁃LPDA mit HCl ist es jedoch nicht möglich, den Mechanismus der thermischen Stabilisierung von 2,3⁃LPDA zu bestimmen. Bei der HCl-Behandlung von 2,3⁃LPDA ist die HCl-Lösung exotherm, während HNO3 unter Hochtemperaturbedingungen leicht in H2O, NO2 und O2 zersetzt wird, was die thermischen Stabilitätseigenschaften von 2,3⁃LPDA nicht beeinflusst. Im FTIR-Spektrum von unbehandeltem 2,3⁃LPDA liegt der Streckschwingungspeak der O-La-Bindung bei 652 cm-1. Nach der Behandlung gab es zwei weitere charakteristische Peaks der O-H-Bindung in den FTIR-Spektren, den teleskopischen Schwingungspeak der O-H-Bindung bei 1.445 cm-1 und den außerhalb der Ebene liegenden teleskopischen Schwingungspeak der O-H-Bindung bei 1.097 cm-1, und in den Spektren erschien wieder der charakteristische Peak der -COOH-Bindung. Daraus lässt sich ableiten, dass die O-La-Bindung gebrochen war und die O-H-Bindung nach der Behandlung rekombiniert wurde. Nachdem die O-La-Bindung gebrochen war, verbanden sich die La-Ionen mit den Cl-Ionen, um die La-Cl-Bindung zu bilden, und aus den FTIR-Spektren des behandelten 2,3 ⁃LPDA wurde ein zusätzlicher Peak bei 1.261 cm-1 in den FTIR-Spektren von 2,3 ⁃LPDA gefunden. Im FTIR-Spektrum von 2,3⁃LPDA nach der Behandlung ist ein Peak bei 1.261 cm-1 zu erkennen, bei dem es sich um den Streckschwingungspeak der La ⁃Cl-Bindung handelt. Es ist zu erkennen, dass 2,3⁃LPDA mit HCl unter Bildung von LaCl3 reagiert. Somit ist bekannt, dass der stabilisierende Mechanismus von 2,3⁃LPDA darin besteht, dass 2,3⁃LPDA das während des thermischen Abbaus von PVC freigesetzte HCl-Gas effektiv absorbieren und LaCl3 bilden kann, was die katalytische Wirkung des thermischen Abbaus von PVC bis zu einem gewissen Grad verzögern kann.