As microesferas magnéticas de biopolímero são um novo material composto que combina materiais biológicos e materiais magnéticos inorgânicos para formar microesferas magneticamente responsivas e biologicamente ativas. Suas propriedades dependem dos materiais magnéticos inorgânicos, dos materiais biológicos e de seu método de interação. Atualmente, o material magnético mais amplamente utilizado e estudado é o Fe3O4 nanopartículas magnéticas. Devido à sua grande área de superfície específica, boa biocompatibilidade e alta resposta magnética, é possível obter uma separação rápida e um movimento direcionado, por isso pode ser amplamente utilizado em alimentos e cuidados médicos, proteção ambiental e outros campos. Os materiais de biopolímero incluem principalmente quitosana, alginato de sódio, gelatina, etc. Entre eles, a quitosana é o material biológico mais estudado devido às suas características próprias de boa biocompatibilidade, recursos renováveis e biodegradabilidade. Um novo tipo de material composto de quitosana e material magnético tem propriedades excelentes e, por isso, tem amplas perspectivas de aplicação em vários campos.

1. Estrutura e propriedades das microesferas magnéticas de biopolímero

A estrutura das microesferas magnéticas de biopolímero inclui três tipos: (1) estrutura núcleo-casca; (2) estrutura híbrida; (3) estrutura sanduíche multicamadas, conforme mostrado na Figura 1.
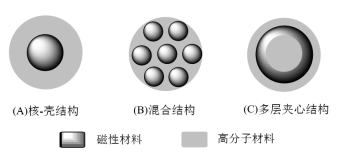
Figura 1 A estrutura das microesferas magnéticas de biopolímero

As microesferas magnéticas de biopolímero têm muitas propriedades excepcionais, o que as torna mais adequadas para a imobilização de enzimas. Por exemplo, (1) efeito da área de superfície. Em geral, quando o tamanho da partícula das microesferas de biopolímero magnético atinge o nível de mícron ou mesmo nanômetro, com o aumento da área de superfície específica, a densidade do grupo e o desempenho de adsorção seletiva das microesferas também aumentam, e a estabilidade das microesferas aumenta significativamente. (2) Efeito magnético. Quando o diâmetro do Fe3O4 Quando o cristal da microesfera é menor que 30 nm, ela tem superparamagnetismo, ou seja, o magnetismo é muito grande sob a condição de campo magnético externo. Quando o campo magnético externo é removido, seu magnetismo desaparece rapidamente, de modo que a microesfera tem orientação magnética sob a condição de campo magnético externo e pode ser rapidamente separada de materiais não magnéticos e não é permanentemente magnetizada em um campo magnético, de modo que não afeta o uso subsequente. (3) Biocompatibilidade. Na natureza, os materiais biológicos, como proteínas e polissacarídeos, têm biocompatibilidade, o que faz com que tenham aplicações importantes na engenharia biomédica. (4) Características da base funcional. Os materiais biológicos, como a quitosana e o alginato de sódio, têm muitos grupos ativos (-OH, -COOH, -NH2), que podem ser combinados covalentemente com substâncias biologicamente ativas ou modificados com determinados grupos químicos.

2. Preparação de microesferas magnéticas de biopolímero

A preparação de microesferas magnéticas de biopolímero é dividida em duas etapas. A primeira etapa é a preparação de nanopartículas magnéticas. Os métodos usados atualmente para preparar nanopartículas de Fe3O4 As nanopartículas magnéticas incluem principalmente a co-precipitação química, a decomposição térmica do sal de ferro, a microemulsão e os métodos hidrotérmicos. Entre eles, o método de co-precipitação química é simples e conveniente de operar e é o método de preparação mais comumente usado. O princípio do método de co-precipitação química para sintetizar Fe3O4 é sintetizar o óxido de ferro aquecendo e agitando uma solução salina mista de uma determinada proporção de Fe2+ e Fe3+ (1:2) em condições anaeróbicas e adicionando rapidamente lixívia (amônia ou NaOH). Xu et al. usaram o método de co-precipitação química para adicionar 4,34 mmol de FeCl2鑘4H2O e 8,67 mmol de FeCl3-6H2O, respectivamente, e aqueça o sistema a 85 ℃ sob nitrogênio. Depois de completamente dissolvido, adicione rapidamente 25 mL de amônia concentrada e adicione uma certa quantidade de citrato de sódio, e então o Fe3O4 nanopartículas magnéticas são sintetizadas com boa monodispersão e capacidade de resposta magnética.

Após a preparação das nanopartículas magnéticas, elas precisam ser reticuladas com quitosana para preparar microesferas magnéticas de quitosana. Atualmente, os métodos de síntese de microesferas magnéticas de quitosana incluem principalmente o método de reticulação de emulsão, o método de secagem por spray, o método fotoquímico e o método in-situ. Entre eles, o método de reticulação de emulsão é mais simples e mais amplamente utilizado. O método de reticulação de emulsão consiste em dispersar uniformemente o Fe3O4 ou fluido magnético em um líquido misto contendo quitosana, surfactante e fase oleosa para formar um sistema de microemulsão água-em-óleo e, em seguida, adicione glutaraldeído; no sistema, o glutaraldeído e a quitosana terão uma reação de reticulação para gerar uma base de Schiff, e a quitosana será reticulada em uma rede e, em seguida, revestirá o Fe3O4 nela (conforme mostrado na Figura 2). Jiang et al. utilizaram o método de reticulação de emulsão, usando Span 80, parafina líquida e glutaraldeído como surfactante, dispersante e agente de reticulação, respectivamente, para sintetizar microesferas magnéticas de quitosana com formas esféricas regulares e superfícies lisas.
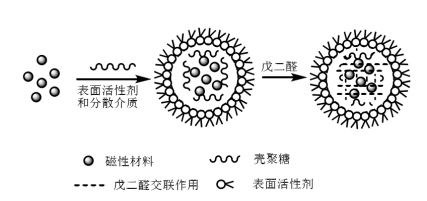
Figura 2 Diagrama esquemático da síntese de microesferas magnéticas de quitosana pelo método de reticulação de emulsão

3. Enzima imobilizada em microesferas magnéticas compostas

Depois que as microesferas magnéticas de quitosana são preparadas com sucesso, a enzima pode ser imobilizada nas microesferas para uso. Como a quitosana é rica em grupos amino ativos e grupos hidroxila, ela pode reagir com grupos carboxila, grupos amino, grupos epóxi, grupos bifuncionais, etc. As microesferas magnéticas de quitosana são modificadas por grupos para atender às necessidades de diferentes imobilizações. Os métodos de preparação de enzimas imobilizadas específicas são apresentados abaixo por grupos funcionais.

1) Enzima imobilizada em microesferas magnéticas compostas modificadas com carboxila
As microesferas magnéticas compostas modificadas com carboxila podem ser ligadas covalentemente ao grupo amino da enzima após serem ativadas pelo acoplamento de carbodiimida em uma solução aquosa, imobilizando assim a molécula da enzima nas microesferas magnéticas compostas (Figura 3). Zhu Yihua e outros usaram um método aprimorado de polimerização em suspensão para copolimerizar o fluido magnético tratado com estireno e o monômero acrilato de metila por meio do monômero de reticulação divinilbenzeno e, em seguida, usaram a hidrólise alcalina para obter um composto magnético com boa monodispersão e grupos carboxílicos ricos. As microesferas são usadas para imobilizar a lactase após serem ativadas pelo acoplamento de carbodiimida. A atividade mais alta é de cerca de 360 U-g-1e a eficiência de reticulação da enzima é de aproximadamente 20%.
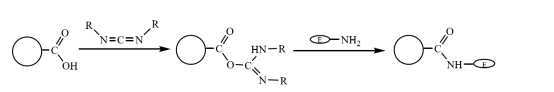
Figura 3 Diagrama esquemático da preparação da enzima imobilizada em microesferas magnéticas compostas modificadas com carboxila

2) Enzima imobilizada em microesferas magnéticas compostas modificadas com aminoácidos
Depois que as microesferas magnéticas compostas modificadas com amino são acopladas a uma quantidade adequada de glutaraldeído e ativadas, elas podem se ligar covalentemente ao grupo amino da enzima, imobilizando assim as moléculas da enzima nas microesferas magnéticas (Figura 4). Liu Yu et al. prepararam sucessivamente microesferas magnéticas monodispersas de SiO2 por método de co-precipitação química e método sol-gel, modificou-as com grupos amino por agente de acoplamento de silano e imobilizou a lacase com glutaraldeído como agente de ligação cruzada. Os resultados mostraram que a lacase imobilizada foi mantida a uma temperatura constante de 60 ℃ por 4 horas e ainda tinha 60,9% de atividade enzimática e, após 10 ciclos de uso, ainda tinha mais de 55% de atividade enzimática, e sua estabilidade térmica e estabilidade operacional foram obviamente melhoradas.
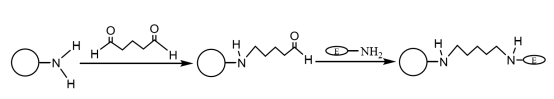
Figura 4 Diagrama esquemático da preparação da enzima imobilizada em microesferas magnéticas compostas modificadas com aminoácidos
3) Microesferas magnéticas compostas modificadas com epóxi e enzima imobilizada
O grupo epóxi é um grupo extremamente ativo. Ele pode ser diretamente ligado de forma covalente a grupos biológicos sem modificação. Portanto, após a ligação covalente das microesferas magnéticas compostas modificadas com epóxi ao grupo amino da enzima para ligar a enzima, as moléculas são imobilizadas nas microesferas magnéticas (Figura 5). Yong et al. prepararam microesferas magnéticas revestidas com ácido oleico por polimerização em suspensão. As microesferas magnéticas hidrofílicas à base de epóxi obtidas após a ativação com metanol foram usadas para a imobilização da lipase. A taxa de retenção da atividade enzimática imobilizada é de 64,2%, e sua estabilidade foi significativamente melhorada.
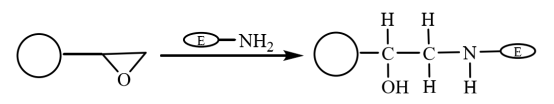
Figura 5 Diagrama esquemático da preparação da enzima imobilizada em microesferas magnéticas compostas à base de epóxi

4) Enzimas imobilizadas em microesferas magnéticas compostas modificadas por grupos bifuncionais

Nas microesferas magnéticas bifuncionais, em primeiro lugar, os grupos carboxila da molécula da enzima e os grupos amino nas microesferas são rapidamente imobilizados no transportador por interação iônica, e a enzima imobilizada por interação iônica interage covalentemente com os grupos epóxi no transportador por meio de seus grupos sulfidrila e amino. Isso faz com que ela seja fixada ainda mais (como mostrado na Figura 6), que tem as características duplas de fixação rápida por ação iônica e fixação firme por ligação covalente. Li Xiutao et al. introduziram três escovas de copolímero randômico na superfície de microesferas de ácido poliacrílico reticulado com divinilbenzeno com Fe3O4 dispersas em seu interior e, em seguida, usadas para imobilizar a penicilina G acilase. Os resultados mostram que a atividade e a taxa de recuperação da atividade enzimática da enzima imobilizada com o grupo epóxi e o grupo amino introduzidos ao mesmo tempo são as mais altas, sua cinética de imobilização é melhor do que a das microesferas magnéticas contendo apenas epóxi, e seu valor de pH ideal e estabilidade de temperatura são mais altos do que a enzima livre, e sua atividade enzimática retém 70% após o uso repetido por 10 vezes.
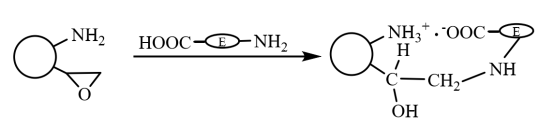
Figura 6 Diagrama esquemático da preparação da enzima imobilizada em microesferas magnéticas compostas modificadas por grupos bifuncionais

Nos últimos anos, embora os estudiosos tenham usado diferentes materiais para imobilizar a naringinase, como materiais de biopolímeros naturais, como quitosana, alginato de sódio e proteína de seda, compostos orgânicos, como resina epóxi e álcool polivinílico, carbono ativado e materiais de carbono de óxido de grafite, como ene, e certos resultados de pesquisa tenham sido obtidos, mas em aplicações reais de desbaste, há problemas como baixa resistência a ácidos das enzimas imobilizadas, separação lenta do suco ou separação incompleta, etc. Com relação aos problemas acima, o próximo artigo apresentará um trabalho de pesquisa em detalhes. Nesse trabalho, os pesquisadores usaram um material composto feito de quitosana, Fe3O4 nanopartículas e sílica, e modificou o material composto com grupos epóxi e, em seguida, imobilizou a naringinase nele. Este trabalho fornecerá a base de dados para estudos adicionais de pesquisas sobre a tecnologia de imobilização da naringinase.
Entre em contato conosco agora!
Se precisar do Price, preencha suas informações de contato no formulário abaixo. Normalmente, entraremos em contato dentro de 24 horas. Você também pode me enviar um e-mail info@longchangchemical.com durante o horário comercial (das 8h30 às 18h UTC+8 de segunda a sábado) ou use o bate-papo ao vivo do site para obter uma resposta imediata.
| Composto Glucoamilase | 9032-08-0 |
| Pullulanase | 9075-68-7 |
| Xilanase | 37278-89-0 |
| Celulase | 9012-54-8 |
| Naringinase | 9068-31-9 |
| β-Amilase | 9000-91-3 |
| Glucose oxidase | 9001-37-0 |
| alfa-Amilase | 9000-90-2 |
| Pectinase | 9032-75-1 |
| Peroxidase | 9003-99-0 |
| Lipase | 9001-62-1 |
| Catalase | 9001-05-2 |
| TANNASE | 9025-71-2 |
| Elastase | 39445-21-1 |
| Urease | 9002-13-5 |
| DEXTRANASE | 9025-70-1 |
| L-Láctico desidrogenase | 9001-60-9 |
| Malato desidrogenase | 9001-64-3 |
| Colesterol oxidase | 9028-76-6 |
