Le microsfere magnetiche di biopolimeri sono un nuovo materiale composito che combina materiali biologici e materiali magnetici inorganici per formare microsfere magneticamente reattive e biologicamente attive. Le sue proprietà dipendono dai materiali magnetici inorganici, dai materiali biologici e dalle loro interazioni. Attualmente, il materiale magnetico più utilizzato e studiato è il Fe3O4 nanoparticelle magnetiche. Grazie all'ampia superficie specifica, alla buona biocompatibilità e all'elevata risposta magnetica, è in grado di ottenere una rapida separazione e un movimento mirato, per cui può essere ampiamente utilizzato in campo alimentare e medico, nella protezione ambientale e in altri settori. I materiali biopolimerici comprendono principalmente chitosano, alginato di sodio, gelatina, ecc. Tra questi, il chitosano è il materiale biologico più studiato grazie alle sue caratteristiche di buona biocompatibilità, risorse rinnovabili e biodegradabilità. Un nuovo tipo di materiale composito composto da chitosano e materiale magnetico ha entrambe le proprietà eccellenti, quindi ha ampie prospettive di applicazione in vari campi.

1. Struttura e proprietà delle microsfere magnetiche di biopolimero

La struttura delle microsfere magnetiche di biopolimeri comprende tre tipi: (1) struttura core-shell; (2) struttura ibrida; (3) struttura sandwich multistrato, come mostrato nella Figura 1.
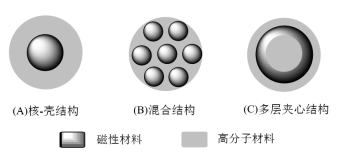
Figura 1 La struttura delle microsfere magnetiche di biopolimero

Le microsfere magnetiche di biopolimero hanno molte proprietà eccezionali, che le rendono più adatte all'immobilizzazione degli enzimi. Come (1) l'effetto area superficiale. In genere, quando la dimensione delle particelle delle microsfere magnetiche di biopolimero raggiunge il livello del micron o addirittura del nanometro, con l'aumento dell'area superficiale specifica, aumentano anche la densità di gruppo e le prestazioni di adsorbimento selettivo delle microsfere e la stabilità delle microsfere aumenta in modo significativo. (2) Effetto magnetico. Quando il diametro del Fe3O4 Il cristallo della microsfera è inferiore a 30 nm e presenta un superpara-magnetismo, cioè un magnetismo molto elevato in presenza di un campo magnetico esterno. Quando il campo magnetico esterno viene rimosso, il suo magnetismo scompare rapidamente, cosicché la microsfera ha un orientamento magnetico in condizioni di campo magnetico esterno e può essere separata rapidamente da materiali non magnetici e non è magnetizzata in modo permanente in un campo magnetico, per cui non influisce sull'uso successivo. (3) Biocompatibilità. In natura, i materiali biologici come le proteine e i polisaccaridi hanno una biocompatibilità che li rende importanti per l'ingegneria biomedica. (4) Caratteristiche funzionali di base. I materiali biologici come il chitosano e l'alginato di sodio presentano numerosi gruppi attivi (-OH, -COOH, -NH2), che possono essere combinati covalentemente con sostanze biologicamente attive o modificati con determinati gruppi chimici.

2. Preparazione di microsfere magnetiche di biopolimero

La preparazione delle microsfere magnetiche di biopolimero si divide in due fasi. La prima fase è la preparazione delle nanoparticelle magnetiche. I metodi attualmente utilizzati per la preparazione di Fe3O4 Le nanoparticelle magnetiche includono principalmente la co-precipitazione chimica, la decomposizione termica del sale di ferro, la microemulsione e i metodi idrotermali. Tra questi, il metodo di co-precipitazione chimica è semplice e conveniente da utilizzare ed è il metodo di preparazione più comunemente usato. Il principio del metodo di co-precipitazione chimica per sintetizzare Fe3O4 è sintetizzare l'ossido di ferro riscaldando e agitando una soluzione salina mista con una certa proporzione di Fe2+ e Fe3+ (1:2) in condizioni anaerobiche e aggiungendo rapidamente soda (ammoniaca o NaOH). Xu et al. hanno utilizzato il metodo di co-precipitazione chimica aggiungendo 4,34 mmol di FeCl2鑘4H2O e 8,67 mmol di FeCl3-6H2O, rispettivamente, e riscaldare il sistema a 85 ℃ sotto azoto. Dopo la completa dissoluzione, aggiungere rapidamente 25 mL di ammoniaca concentrata e aggiungere una certa quantità di citrato di sodio, quindi il Fe3O4 nanoparticelle magnetiche sintetizzate con buona monodispersione e reattività magnetica.

Dopo la preparazione delle nanoparticelle magnetiche, queste devono essere reticolate con il chitosano per preparare microsfere di chitosano magnetico. Attualmente, i metodi di sintesi delle microsfere di chitosano magnetico includono principalmente il metodo di reticolazione in emulsione, il metodo di essiccazione a spruzzo, il metodo fotochimico e il metodo in situ. Tra questi, il metodo di reticolazione in emulsione è il più semplice e il più utilizzato. Il metodo di reticolazione in emulsione consiste nel disperdere uniformemente Fe3O4 o fluido magnetico in un liquido misto contenente chitosano, tensioattivo e fase oleosa per formare un sistema di microemulsione acqua-in-olio, e poi aggiungere glutaraldeide; nel sistema glutaraldeide e chitosano avranno una reazione di reticolazione che genererà una base di Schiff, e il chitosano si reticolerà in una rete e poi rivestirà Fe3O4 in essa (come mostrato nella Figura 2). Jiang et al. hanno utilizzato il metodo di reticolazione in emulsione, usando Span 80, paraffina liquida e glutaraldeide rispettivamente come tensioattivo, disperdente e agente reticolante, per sintetizzare microsfere di chitosano magnetico con forme sferiche regolari e superfici lisce.
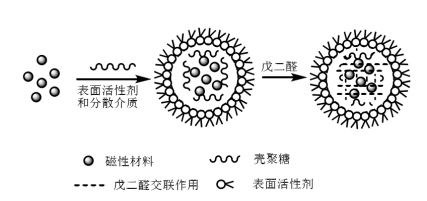
Figura 2 Schema della sintesi di microsfere di chitosano magnetico con il metodo della reticolazione in emulsione

3. Enzima immobilizzato su microsfere magnetiche composite

Dopo aver preparato con successo le microsfere magnetiche di chitosano, l'enzima può essere immobilizzato sulle microsfere per essere utilizzato. Poiché il chitosano è ricco di gruppi amminici e idrossilici attivi, può reagire con gruppi carbossilici, gruppi amminici, gruppi epossidici, gruppi bifunzionali, ecc. Le microsfere magnetiche di chitosano sono modificate in base ai gruppi per soddisfare le esigenze di immobilizzazione. I metodi di preparazione di specifici enzimi immobilizzati sono introdotti di seguito per gruppi funzionali.

1) Enzima immobilizzato su microsfere magnetiche composite modificate con carbossile
Le microsfere magnetiche composite modificate con carbossile possono essere legate covalentemente al gruppo amminico dell'enzima dopo essere state attivate dall'accoppiamento con carbodiimmide in una soluzione acquosa, immobilizzando così la molecola di enzima sulle microsfere magnetiche composite (Figura 3). Zhu Yihua e altri hanno utilizzato un metodo di polimerizzazione in sospensione migliorato per copolimerizzare il fluido magnetico trattato con stirene e il monomero metilacrilato attraverso il monomero reticolante divinilbenzene, quindi utilizzare l'idrolisi alcalina per ottenere un composito magnetico con una buona monodispersione e ricco di gruppi carbossilici. Le microsfere sono utilizzate per immobilizzare la lattasi dopo essere state attivate dall'accoppiamento con la carbodiimmide. L'attività massima è di circa 360 U-g-1e l'efficienza di reticolazione dell'enzima è di circa 20%.
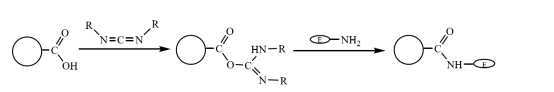
Figura 3 Schema della preparazione dell'enzima immobilizzato su microsfere magnetiche composite modificate con carbossile

2) Microsfere magnetiche composite amino modificate immobilizzate con l'enzima
Dopo che le microsfere magnetiche composite ammino-modificate sono state accoppiate con una quantità appropriata di glutaraldeide e attivate, possono legarsi covalentemente al gruppo amminico dell'enzima, immobilizzando così le molecole di enzima sulle microsfere magnetiche (Figura 4). Liu Yu et al. hanno preparato successivamente microsfere magnetiche monodisperse di SiO2 particelle mediante il metodo di co-precipitazione chimica e il metodo sol-gel, le ha modificate con gruppi amminici mediante l'agente di accoppiamento silano e ha immobilizzato la laccasi con la glutaraldeide come agente di reticolazione. I risultati hanno mostrato che la laccasi immobilizzata è stata mantenuta a una temperatura costante di 60 ℃ per 4 ore e aveva ancora un'attività enzimatica di 60,9%; dopo 10 cicli di utilizzo, aveva ancora un'attività enzimatica di oltre 55% e la sua stabilità termica e operativa erano ovviamente migliorate.
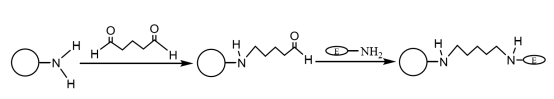
Figura 4 Schema della preparazione dell'enzima immobilizzato su microsfere magnetiche composite ammino-modificate
3) Microsfere magnetiche composite modificate con epossidico immobilizzate con enzimi
Il gruppo epossidico è un gruppo estremamente attivo. Può essere legato direttamente in modo covalente a gruppi biologici senza alcuna modifica. Pertanto, dopo che le microsfere magnetiche composite modificate con epossidico si sono legate covalentemente al gruppo amminico dell'enzima per legare l'enzima, le molecole vengono immobilizzate sulle microsfere magnetiche (Figura 5). Yong et al. hanno preparato microsfere magnetiche rivestite di acido oleico mediante polimerizzazione in sospensione. Le microsfere magnetiche idrofile a base epossidica ottenute dopo l'attivazione con metanolo sono state utilizzate per l'immobilizzazione della lipasi. Il tasso di ritenzione dell'attività enzimatica immobilizzata è di 64,2% e la sua stabilità è notevolmente migliorata.
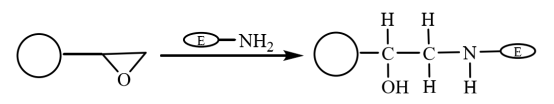
Figura 5 Schema della preparazione dell'enzima immobilizzato su microsfere magnetiche composite a base epossidica

4) Enzimi immobilizzati su microsfere magnetiche composite modificate da gruppi bifunzionali

Sulle microsfere magnetiche bifunzionali, in primo luogo, i gruppi carbossilici della molecola enzimatica e i gruppi amminici sulle microsfere vengono rapidamente immobilizzati sul supporto per interazione ionica, e l'enzima immobilizzato per interazione ionica interagisce covalentemente con i gruppi epossidici sul supporto attraverso i suoi gruppi sulfidrilici e amminici. L'enzima immobilizzato dall'interazione ionica interagisce covalentemente con i gruppi epossidici del carrier attraverso i suoi gruppi sulfidrilici e amminici e si fissa ulteriormente (come mostrato nella Figura 6), con la duplice caratteristica di fissazione rapida per azione ionica e di fissazione stabile per legame covalente. Li Xiutao et al. hanno introdotto tre spazzole copolimeriche casuali sulla superficie di microsfere di acido poliacrilico reticolate con divinilbenzene e Fe3O4 nanoparticelle disperse all'interno e poi utilizzate per immobilizzare la penicillina G acilasi. I risultati mostrano che l'attività e il tasso di recupero dell'attività enzimatica dell'enzima immobilizzato con gruppo epossidico e gruppo amminico introdotti contemporaneamente sono i più alti, la sua cinetica di immobilizzazione è migliore di quella delle microsfere magnetiche contenenti solo epossidico, e il suo valore ottimale di pH e la sua stabilità alla temperatura sono più alti dell'enzima libero, e la sua attività enzimatica mantiene 70% dopo l'uso ripetuto per 10 volte.
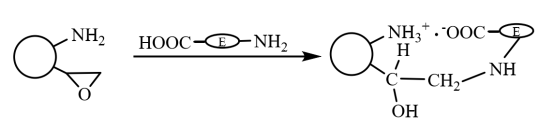
Figura 6 Schema della preparazione dell'enzima immobilizzato su microsfere magnetiche composite modificate da gruppi bifunzionali

Negli ultimi anni, sebbene gli studiosi abbiano utilizzato diversi materiali per immobilizzare la naringinasi, quali biopolimeri naturali come il chitosano, l'alginato di sodio e le proteine della seta, composti organici come la resina epossidica e l'alcol polivinilico, carbone attivo e materiali carboniosi a base di ossido di grafite come l'ene, e siano stati ottenuti alcuni risultati di ricerca, nelle applicazioni effettive di deamarizzazione si riscontrano problemi quali la scarsa resistenza agli acidi degli enzimi immobilizzati, la lenta separazione dal succo o la separazione incompleta, ecc. Per quanto riguarda questi problemi, il prossimo articolo presenterà in dettaglio un lavoro di ricerca. In questo lavoro, i ricercatori hanno utilizzato un materiale composito costituito da chitosano, Fe magnetico e Fe3O4 nanoparticelle e silice, modificando il materiale composito con gruppi epossidici e immobilizzandovi poi la naringinasi. Questo lavoro fornirà una base di dati per ulteriori studi sulla tecnologia di immobilizzazione della naringinasi.
Contattateci ora!
Se avete bisogno di Price, inserite i vostri dati di contatto nel modulo sottostante; di solito vi contatteremo entro 24 ore. Potete anche inviarmi un'e-mail info@longchangchemical.com durante l'orario di lavoro (dalle 8:30 alle 18:00 UTC+8 lun.-sab.) o utilizzare la live chat del sito web per ottenere una risposta immediata.
| Composto Glucoamilasi | 9032-08-0 |
| Pullulanase | 9075-68-7 |
| Xilanasi | 37278-89-0 |
| Cellulasi | 9012-54-8 |
| Naringinasi | 9068-31-9 |
| β-amilasi | 9000-91-3 |
| Glucosio ossidasi | 9001-37-0 |
| alfa-amilasi | 9000-90-2 |
| Pectinasi | 9032-75-1 |
| Perossidasi | 9003-99-0 |
| Lipasi | 9001-62-1 |
| Catalasi | 9001-05-2 |
| TANNASIO | 9025-71-2 |
| Elastasi | 39445-21-1 |
| Ureasi | 9002-13-5 |
| DEXTRANASE | 9025-70-1 |
| L-lattico deidrogenasi | 9001-60-9 |
| Deidrogenasi malato | 9001-64-3 |
| Colesterolo ossidasi | 9028-76-6 |
