Magnetische biopolymeermicrosferen zijn een nieuw composietmateriaal dat biologische materialen en anorganische magnetische materialen combineert om magnetisch reagerende en biologisch actieve microsferen te vormen. De eigenschappen zijn afhankelijk van anorganische magnetische materialen, biologische materialen en hun interactiemethode. Op dit moment is het meest gebruikte en bestudeerde magnetische materiaal Fe3O4 magnetische nanodeeltjes. Door het grote specifieke oppervlak, de goede biocompatibiliteit en de hoge magnetische respons kan het een snelle scheiding en gerichte beweging bewerkstelligen, zodat het op grote schaal kan worden gebruikt in voeding en medische zorg, milieubescherming en andere gebieden. Biopolymeermaterialen omvatten voornamelijk chitosan, natriumalginaat, gelatine, enz. Chitosan is het meest bestudeerde biologische materiaal vanwege zijn goede biocompatibiliteit, hernieuwbare bronnen en biologische afbreekbaarheid. Een nieuw type composietmateriaal samengesteld uit chitosan en magnetisch materiaal heeft beide uitstekende eigenschappen, dus het heeft brede toepassingsmogelijkheden op verschillende gebieden.

1. Structuur en eigenschappen van magnetische biopolymeer microsferen

De structuur van magnetische biopolymeer microsferen omvat drie typen: (1) core-shell structuur; (2) hybride structuur; (3) meerlagige sandwichstructuur, zoals weergegeven in figuur 1.
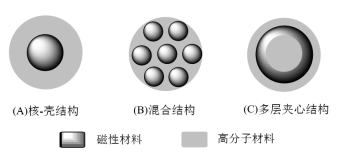
Figuur 1 De structuur van magnetische biopolymeer microsferen

Magnetische biopolymeermicrosferen hebben veel uitstekende eigenschappen, waardoor ze geschikter zijn voor enzymimmobilisatie. Zoals (1) oppervlakte-effect. Wanneer de deeltjesgrootte van magnetische biopolymeermicrosferen het micron- of zelfs nanometerniveau bereikt, neemt het specifieke oppervlak toe, nemen de groepsdichtheid en de selectieve adsorptieprestaties van de microsferen ook toe en neemt de stabiliteit van de microsferen aanzienlijk toe. (2) Magnetisch effect. Wanneer de diameter van Fe3O4 kristal minder dan 30 nm is, heeft het superparamagnetisme, d.w.z. het magnetisme is zeer groot onder de voorwaarde van extern magnetisch veld. Wanneer het externe magnetische veld wordt verwijderd, verdwijnt het magnetisme snel, zodat de microsfeer magnetische oriëntatie heeft onder de voorwaarde van een extern magnetisch veld en snel kan worden gescheiden van niet-magnetische materialen en niet permanent wordt gemagnetiseerd in een magnetisch veld, zodat het geen invloed heeft op later gebruik. (3) Biocompatibiliteit. In de natuur hebben biologische materialen zoals eiwitten en polysacchariden biocompatibiliteit, waardoor ze belangrijke toepassingen hebben in biomedische engineering. (4) Functionele basiseigenschappen. Biologische materialen zoals chitosan en natriumalginaat hebben veel actieve groepen (-OH, -COOH, -NH2), die covalent gecombineerd kunnen worden met biologisch actieve stoffen of gemodificeerd kunnen worden met bepaalde chemische groepen.

2. Bereiding van magnetische biopolymeermicrosferen

De bereiding van magnetische biopolymeermicrosferen is verdeeld in twee stappen. De eerste stap is de bereiding van magnetische nanodeeltjes. De methoden die momenteel worden gebruikt om Fe3O4 magnetische nanodeeltjes bestaan voornamelijk uit chemische coprecipitatie, thermische ontleding met ijzerzout, micro-emulsie en hydrothermische methoden. De chemische coprecipitatiemethode is eenvoudig en gemakkelijk te gebruiken en is de meest gebruikte bereidingsmethode. Het principe van de chemische coprecipitatiemethode om Fe3O4 is ijzeroxide te synthetiseren door een gemengde zoutoplossing van een bepaalde hoeveelheid Fe2+ en Fe3+ (1:2) onder anaerobe omstandigheden en het snel toevoegen van loog (ammoniak of NaOH). Xu et al. gebruikten de chemische coprecipitatiemethode om 4,34 mmol FeCl2鑘4H2O en 8,67 mmol FeCl3-6H2O, respectievelijk, en verwarm het systeem tot 85 ℃ onder stikstof. Nadat het volledig was opgelost, voeg dan snel 25 mL geconcentreerde ammoniak en een bepaalde hoeveelheid natriumcitraat, dan is de Fe3O4 magnetische nanodeeltjes gesynthetiseerd met goede monodispersiteit en magnetische responsiviteit.

Na de bereiding van magnetische nanodeeltjes moeten ze worden vernet met chitosan om magnetische chitosan microsferen te maken. Momenteel omvatten de synthesemethoden voor magnetische chitosan microsferen voornamelijk emulsie-crosslinkingmethode, sproeidroogmethode, fotochemische methode en in-situ methode. De emulsie vernettingsmethode is eenvoudiger en wordt het meest gebruikt. Bij de emulsieverknopingsmethode wordt Fe3O4 of magnetische vloeistof in een gemengde vloeistof die chitosan, oppervlakteactieve stof en oliefase bevat om een water-in-olie micro-emulsiesysteem te vormen, en voeg dan glutaaraldehyde toe, in het systeem zullen glutaaraldehyde en chitosan een vernettingsreactie ondergaan om een Schiff-base te genereren, en het chitosan zal een netwerk vormen en vervolgens Fe3O4 erin (zoals getoond in Figuur 2). Jiang et al. gebruikten de emulsie-crosslinkingmethode, met Span 80, vloeibare paraffine en glutaaraldehyde als respectievelijk oppervlakteactieve stof, dispergeermiddel en crosslinking-agent, om magnetische chitosanmicrosferen met regelmatige bolvormen en gladde oppervlakken te synthetiseren.
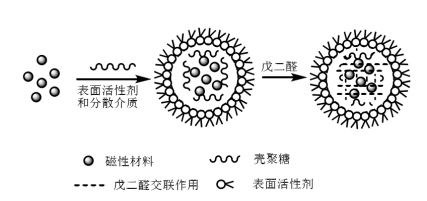
Figuur 2 Schematische weergave van de synthese van magnetische chitosan microsferen door emulsieverknopingsmethode

3. Enzym geïmmobiliseerd op magnetische composietmicrosferen

Nadat de magnetische chitosan microsferen met succes zijn bereid, kan het enzym op de microsferen worden geïmmobiliseerd voor gebruik. Aangezien chitosan rijk is aan actieve aminogroepen en hydroxylgroepen, kan het reageren met carboxylgroepen, aminogroepen, epoxygroepen, bifunctionele groepen, enz. De magnetische chitosan microsferen zijn groepsgewijs gemodificeerd om aan de behoeften van verschillende immobilisaties te voldoen. De bereidingswijzen van specifieke geïmmobiliseerde enzymen worden hieronder per functionele groep geïntroduceerd.

1) Enzym geïmmobiliseerd op carboxylgemodificeerde magnetische composietmicrosferen
De carboxylgemodificeerde magnetische composietmicrosferen kunnen covalent worden gebonden aan de aminogroep van het enzym nadat ze zijn geactiveerd door carbodiimidekoppeling in een waterige oplossing, waardoor het enzymmolecuul wordt geïmmobiliseerd op de magnetische composietmicrosferen (figuur 3). Zhu Yihua en anderen gebruikten een verbeterde suspensiepolymerisatiemethode om de styreenbehandelde magnetische vloeistof en het monomeer methylacrylaat te copolymeriseren via het crosslinkingmonomeer divinylbenzeen, en gebruiken vervolgens alkalihydrolyse om een magnetisch composiet te verkrijgen met een goede monodispersiteit en rijke carboxylgroepen. De microsferen worden gebruikt om lactase te immobiliseren nadat ze zijn geactiveerd door carbodiimidekoppeling. De hoogste activiteit is ongeveer 360 U-g-1en de verknopingsefficiëntie van het enzym is ongeveer 20%.
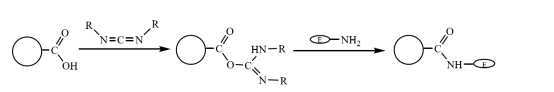
Figuur 3 Schematische weergave van de bereiding van geïmmobiliseerd enzym op carboxylgemodificeerde magnetische composietmicrosferen

2) Aminomodificeerde magnetische composietmicrosferen geïmmobiliseerd enzym
Nadat de amino-gemodificeerde magnetische composietmicrosferen zijn gekoppeld met een geschikte hoeveelheid glutaaraldehyde en geactiveerd, kunnen ze zich covalent binden aan de aminogroep op het enzym, waardoor de enzymmoleculen op de magnetische microsferen worden geïmmobiliseerd (figuur 4). Liu Yu et al. bereidden achtereenvolgens monodisperse magnetische SiO2 deeltjes door middel van chemische coprecipitatiemethode en sol-gelmethode, gemodificeerd met aminogroepen door silaankoppelingsmiddel en geïmmobiliseerd laccase met glutaaraldehyde als de cross-linking agent. De resultaten toonden aan dat de geïmmobiliseerde laccase werd gehouden bij een constante temperatuur van 60 ℃ gedurende 4 uur, en nog steeds 60.9% enzymactiviteit had, en na 10 cycli van gebruik, had het nog steeds meer dan 55% enzymactiviteit, en de thermische stabiliteit en operationele stabiliteit waren duidelijk verbeterd.
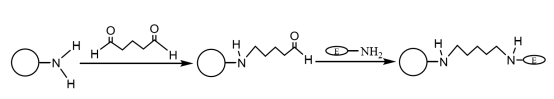
Figuur 4 Schematische weergave van de bereiding van geïmmobiliseerd enzym op amino-gemodificeerde magnetische composietmicrosferen
3) Epoxy gemodificeerde magnetische composietmicrosferen geïmmobiliseerd enzym
Epoxygroep is een extreem actieve groep. Het kan direct covalent worden gebonden aan biologische groepen zonder modificatie. Daarom worden de moleculen na de epoxygemodificeerde magnetische composietmicrosferen covalent gebonden aan de aminogroep op het enzym om het enzym te binden, geïmmobiliseerd op de magnetische microsferen (figuur 5). Yong et al. bereidden met oliezuur gecoate magnetische microsferen door suspensiepolymerisatie. De hydrofiele magnetische microsferen op epoxybasis, verkregen na activering met methanol, werden gebruikt voor immobilisatie van lipase. De retentiesnelheid van de geïmmobiliseerde enzymactiviteit is 64,2% en de stabiliteit is aanzienlijk verbeterd.
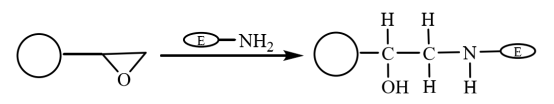
Figuur 5 Schematische weergave van de bereiding van geïmmobiliseerd enzym op epoxygebaseerde magnetische composietmicrosferen

4) Enzymen geïmmobiliseerd op magnetische composietmicrosferen gemodificeerd door bifunctionele groepen

Op de bifunctionele magnetische microsferen worden ten eerste de carboxylgroepen van het enzymmolecuul en de aminogroepen op de microsferen snel geïmmobiliseerd op de drager door ioninteractie, en het enzym geïmmobiliseerd door ioninteractie heeft een covalente interactie met de epoxygroepen op de drager via zijn sulfhydryl- en aminogroepen. Hierdoor wordt het verder gefixeerd (zoals getoond in Figuur 6), wat de dubbele eigenschap heeft van snelle fixatie door ionische werking en stevige fixatie door covalente binding. Li Xiutao et al. introduceerden drie willekeurige copolymeerborstels op het oppervlak van divinylbenzeen vernet polyacrylzuurmicrosferen met Fe3O4 nanodeeltjes gedispergeerd en vervolgens gebruikt om penicilline G-cylase te immobiliseren. De resultaten tonen aan dat de activiteit en de herstelsnelheid van de enzymactiviteit van het geïmmobiliseerde enzym met zowel de epoxygroep als de aminogroep tegelijkertijd het hoogst zijn, dat de immobilisatiekinetiek beter is dan die van alleen epoxybevattende magnetische microsferen en dat de optimale pH-waarde en temperatuurstabiliteit hoger zijn dan die van het vrije enzym en dat de enzymactiviteit 70% behoudt na 10 keer herhaald gebruik.
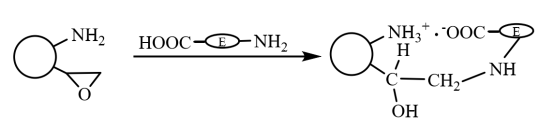
Figuur 6 Schematische weergave van de bereiding van geïmmobiliseerd enzym op magnetische composietmicrosferen gemodificeerd met bifunctionele groepen

In de afgelopen jaren hebben wetenschappers verschillende materialen gebruikt om naringinase te immobiliseren, zoals natuurlijke biopolymere materialen zoals chitosan, natriumalginaat en zijdeproteïne, organische verbindingen zoals epoxyhars en polyvinylalcohol, actieve kool en grafietoxidekoolstofmaterialen zoals ene, en er zijn bepaalde onderzoeksresultaten verkregen, maar in daadwerkelijke debitteringstoepassingen zijn er problemen zoals een slechte zuurbestendigheid van geïmmobiliseerde enzymen, langzame scheiding van sap of onvolledige scheiding, enz. Met betrekking tot de bovenstaande problemen zal in het volgende artikel een onderzoekswerk in detail worden geïntroduceerd. In dit wok gebruikten de onderzoekers een composietmateriaal gemaakt van chitosan, magnetisch Fe3O4 nanodeeltjes en silica, wijzigde het composietmateriaal met epoxygroepen en immobiliseerde er vervolgens naringinase op. Dit werk biedt een basis voor verder onderzoek naar naringinase immobilisatietechnologie.
Neem nu contact met ons op!
Als je Price nodig hebt, vul dan je contactgegevens in op het formulier hieronder. We nemen dan meestal binnen 24 uur contact met je op. Je kunt me ook een e-mail sturen info@longchangchemical.com tijdens kantooruren (8:30 tot 18:00 UTC+8 ma. ~ za.) of gebruik de live chat op de website voor een snel antwoord.
| Samenstelling Glucoamylase | 9032-08-0 |
| Pullulanase | 9075-68-7 |
| Xylanase | 37278-89-0 |
| Cellulase | 9012-54-8 |
| Naringinase | 9068-31-9 |
| β-amylase | 9000-91-3 |
| Glucose-oxidase | 9001-37-0 |
| alfa-amylase | 9000-90-2 |
| Pectinase | 9032-75-1 |
| Peroxidase | 9003-99-0 |
| Lipase | 9001-62-1 |
| Katalase | 9001-05-2 |
| TANNASE | 9025-71-2 |
| Elastase | 39445-21-1 |
| Urease | 9002-13-5 |
| DEXTRANASE | 9025-70-1 |
| L-Lactische dehydrogenase | 9001-60-9 |
| Dehydrogenase malaat | 9001-64-3 |
| Cholesteroloxidase | 9028-76-6 |
