Les microsphères de biopolymères magnétiques sont un nouveau matériau composite qui combine des matériaux biologiques et des matériaux magnétiques inorganiques pour former des microsphères sensibles au magnétisme et biologiquement actives. Ses propriétés dépendent des matériaux magnétiques inorganiques, des matériaux biologiques et de leur méthode d'interaction. À l'heure actuelle, le matériau magnétique le plus largement utilisé et étudié est le Fe3O4 nanoparticules magnétiques. En raison de leur grande surface spécifique, de leur bonne biocompatibilité et de leur forte réponse magnétique, elles peuvent réaliser une séparation rapide et un déplacement ciblé, ce qui leur permet d'être largement utilisées dans l'alimentation, les soins médicaux, la protection de l'environnement et d'autres domaines. Les matériaux biopolymères comprennent principalement le chitosane, l'alginate de sodium, la gélatine, etc. Parmi eux, le chitosane est le matériau biologique le plus étudié en raison de ses caractéristiques propres : bonne biocompatibilité, ressources renouvelables et biodégradabilité. Un nouveau type de matériau composite composé de chitosane et de matériau magnétique possède d'excellentes propriétés, ce qui lui confère de vastes perspectives d'application dans divers domaines.

1. Structure et propriétés des microsphères magnétiques en biopolymère

La structure des microsphères magnétiques en biopolymère comprend trois types : (1) structure cœur-coquille ; (2) structure hybride ; (3) structure sandwich multicouche, comme le montre la figure 1.
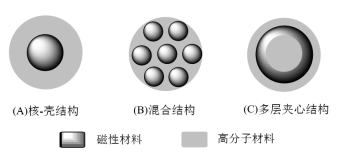
Figure 1 Structure des microsphères magnétiques en biopolymère

Les microsphères magnétiques en biopolymère possèdent de nombreuses propriétés exceptionnelles qui les rendent plus adaptées à l'immobilisation des enzymes. Il s'agit notamment de (1) l'effet de surface. En général, lorsque la taille des particules des microsphères magnétiques de biopolymère atteint le micron ou même le nanomètre, avec l'augmentation de la surface spécifique, la densité de groupe et la performance d'adsorption sélective des microsphères augmentent également, et la stabilité des microsphères s'accroît de manière significative. (2) Effet magnétique. Lorsque le diamètre du Fe3O4 Le cristal de la microsphère est inférieur à 30 nm, il possède un super para-magnétisme, c'est-à-dire que le magnétisme est très important sous l'effet d'un champ magnétique externe. Lorsque le champ magnétique externe est supprimé, son magnétisme disparaît rapidement, de sorte que la microsphère a une orientation magnétique sous l'effet du champ magnétique externe et peut être séparée rapidement des matériaux non magnétiques et n'est pas magnétisée de manière permanente dans un champ magnétique, ce qui n'affecte pas son utilisation ultérieure. (3) Biocompatibilité. Dans la nature, les matériaux biologiques tels que les protéines et les polysaccharides sont biocompatibles, ce qui leur confère des applications importantes dans le domaine de l'ingénierie biomédicale. (4) Caractéristiques fonctionnelles de base. Les matériaux biologiques tels que le chitosane et l'alginate de sodium possèdent de nombreux groupes actifs (-OH, -COOH, -NH2), qui peuvent être combinés de manière covalente avec des substances biologiquement actives ou modifiés par certains groupes chimiques.

2. Préparation de microsphères magnétiques en biopolymère

La préparation des microsphères magnétiques en biopolymère se fait en deux étapes. La première étape est la préparation des nanoparticules magnétiques. Les méthodes actuellement utilisées pour préparer les nanoparticules de Fe3O4 Les méthodes de préparation des nanoparticules magnétiques comprennent principalement la co-précipitation chimique, la décomposition thermique des sels de fer, la microémulsion et les méthodes hydrothermales. Parmi elles, la méthode de la co-précipitation chimique est simple et pratique à mettre en œuvre, et c'est la méthode de préparation la plus couramment utilisée. Le principe de la méthode de co-précipitation chimique pour synthétiser le Fe3O4 consiste à synthétiser de l'oxyde de fer en chauffant et en agitant une solution saline mixte contenant une certaine proportion de Fe2+ et Fe3+ (1:2) dans des conditions anaérobies et en ajoutant rapidement de la lessive (ammoniaque ou NaOH). Xu et al. ont utilisé la méthode de coprécipitation chimique pour ajouter 4,34 mmol de FeCl2鑘4H2O et 8,67 mmol FeCl3-6H2O, respectivement, et chauffer le système à 85 ℃ sous azote. Après dissolution complète, ajouter rapidement 25 mL d'ammoniaque concentré et ajouter une certaine quantité de citrate de sodium, puis le Fe3O4 sont synthétisées avec une bonne mono-disponibilité et une bonne réactivité magnétique.

Après la préparation des nanoparticules magnétiques, celles-ci doivent être réticulées avec du chitosane pour préparer des microsphères de chitosane magnétique. À l'heure actuelle, les méthodes de synthèse des microsphères de chitosane magnétique comprennent principalement la méthode de réticulation en émulsion, la méthode de séchage par pulvérisation, la méthode photochimique et la méthode in situ. La méthode de réticulation par émulsion est la plus simple et la plus utilisée. La méthode de réticulation en émulsion consiste à disperser uniformément le Fe3O4 ou un fluide magnétique dans un liquide mixte contenant du chitosane, un surfactant et une phase huileuse pour former un système de microémulsion eau dans huile, puis ajouter du glutaraldéhyde, dans le système le glutaraldéhyde et le chitosane auront une réaction de réticulation pour générer une base de Schiff, et le chitosane se réticulera en un réseau et enduira ensuite le Fe3O4 (comme le montre la figure 2). Jiang et al. ont utilisé la méthode de réticulation en émulsion, en utilisant le Span 80, la paraffine liquide et le glutaraldéhyde comme agent tensioactif, dispersant et réticulant, respectivement, pour synthétiser des microsphères de chitosane magnétique aux formes sphériques régulières et aux surfaces lisses.
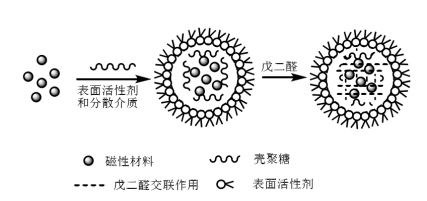
Figure 2 Schéma de la synthèse de microsphères de chitosane magnétique par la méthode de réticulation en émulsion

3. Enzyme immobilisée sur des microsphères composites magnétiques

Une fois les microsphères magnétiques de chitosane préparées avec succès, l'enzyme peut être immobilisée sur les microsphères pour être utilisée. Le chitosane étant riche en groupes aminés actifs et en groupes hydroxyles, il peut réagir avec des groupes carboxyles, des groupes aminés, des groupes époxy, des groupes bifonctionnels, etc. Les microsphères magnétiques de chitosane sont modifiées en fonction des groupes pour répondre aux besoins de différentes immobilisations. Les méthodes de préparation des enzymes immobilisées spécifiques sont présentées ci-dessous par groupe fonctionnel.

1) Enzyme immobilisée sur des microsphères composites magnétiques modifiées par des carboxyles
Les microsphères composites magnétiques modifiées par le carboxyle peuvent être liées de manière covalente au groupe amino de l'enzyme après avoir été activées par couplage au carbodiimide dans une solution aqueuse, immobilisant ainsi la molécule d'enzyme sur les microsphères composites magnétiques (figure 3). Zhu Yihua et d'autres ont utilisé une méthode améliorée de polymérisation en suspension pour copolymériser le fluide magnétique traité au styrène et le monomère acrylate de méthyle par l'intermédiaire du monomère réticulant divinylbenzène, puis utiliser l'hydrolyse alcaline pour obtenir un composite magnétique avec une bonne mono-disponibilité et des groupes carboxyles riches. Les microsphères sont utilisées pour immobiliser la lactase après avoir été activées par couplage carbodiimide. L'activité la plus élevée est d'environ 360 U-g-1et l'efficacité de réticulation de l'enzyme est d'environ 20%.
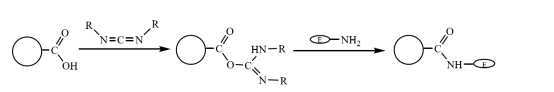
Figure 3 Schéma de préparation de l'enzyme immobilisée sur des microsphères composites magnétiques modifiées par des carboxyles

2) Microsphères composites magnétiques modifiées par des amines et immobilisées par une enzyme
Une fois que les microsphères magnétiques composites modifiées par des amines sont couplées à une quantité appropriée de glutaraldéhyde et activées, elles peuvent se lier de manière covalente au groupe aminé de l'enzyme, immobilisant ainsi les molécules d'enzyme sur les microsphères magnétiques (figure 4). Liu Yu et al. ont préparé successivement des microsphères magnétiques monodisperses de SiO2 par la méthode de co-précipitation chimique et la méthode sol-gel, les a modifiées avec des groupes aminés par l'agent de couplage silane, et a immobilisé la laccase avec le glutaraldéhyde comme agent de réticulation. Les résultats ont montré que la laccase immobilisée a été maintenue à une température constante de 60 ℃ pendant 4 heures et qu'elle avait encore une activité enzymatique de 60,9%, et qu'après 10 cycles d'utilisation, elle avait encore une activité enzymatique de plus de 55%, et que sa stabilité thermique et sa stabilité opérationnelle étaient nettement améliorées.
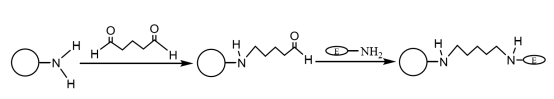
Figure 4 Schéma de préparation de l'enzyme immobilisée sur des microsphères magnétiques composites modifiées par des amines
3) Microsphères magnétiques composites modifiées à l'époxy immobilisant l'enzyme
Le groupe époxy est un groupe extrêmement actif. Il peut être directement lié de manière covalente à des groupes biologiques sans modification. Par conséquent, après que les microsphères magnétiques composites modifiées par l'époxyde se soient liées de manière covalente au groupe amino de l'enzyme pour lier l'enzyme, les molécules sont immobilisées sur les microsphères magnétiques (figure 5). Yong et al. ont préparé des microsphères magnétiques recouvertes d'acide oléique par polymérisation en suspension. Les microsphères magnétiques hydrophiles à base d'époxy obtenues après activation avec du méthanol ont été utilisées pour l'immobilisation de la lipase. Le taux de rétention de l'activité enzymatique immobilisée est de 64,2%, et sa stabilité est considérablement améliorée.
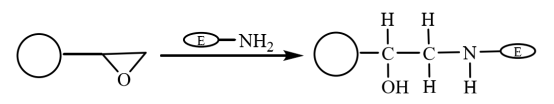
Figure 5 Schéma de préparation de l'enzyme immobilisée sur des microsphères composites magnétiques à base d'époxy.

4) Enzymes immobilisées sur des microsphères composites magnétiques modifiées par des groupes bifonctionnels

Sur les microsphères magnétiques bifonctionnelles, les groupes carboxyle de la molécule d'enzyme et les groupes amino des microsphères sont rapidement immobilisés sur le support par interaction ionique, et l'enzyme immobilisée par interaction ionique interagit de manière covalente avec les groupes époxy du support par l'intermédiaire de ses groupes sulfhydryle et amino. L'enzyme immobilisée par interaction ionique interagit de manière covalente avec les groupes époxy du support par l'intermédiaire de ses groupes sulfhydryle et amino, ce qui permet de la fixer davantage (comme le montre la figure 6). Li Xiutao et al. ont introduit trois brosses de copolymères aléatoires à la surface de microsphères d'acide polyacrylique réticulé au divinylbenzène avec du Fe3O4 Les résultats montrent que l'activité et le taux de récupération de l'activité enzymatique de l'enzyme immobilisée avec le groupe époxy et le groupe amino introduits en même temps sont les plus élevés. Les résultats montrent que l'activité et le taux de récupération de l'activité enzymatique de l'enzyme immobilisée avec le groupe époxy et le groupe amino introduits en même temps sont les plus élevés, sa cinétique d'immobilisation est meilleure que celle des microsphères magnétiques contenant uniquement de l'époxy, et sa valeur pH optimale et sa stabilité à la température sont plus élevées que celles de l'enzyme libre, et son activité enzymatique conserve 70% après une utilisation répétée pendant 10 fois.
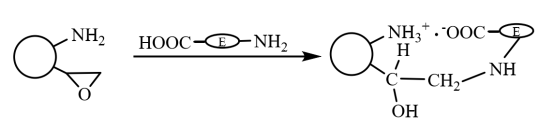
Figure 6 Schéma de préparation de l'enzyme immobilisée sur des microsphères composites magnétiques modifiées par des groupes bifonctionnels

Ces dernières années, bien que les chercheurs aient utilisé différents matériaux pour immobiliser la naringinase, tels que des biopolymères naturels comme le chitosane, l'alginate de sodium et la protéine de soie, des composés organiques comme la résine époxy et l'alcool polyvinylique, du charbon actif et des matériaux carbonés à base d'oxyde de graphite comme l'ene, certains résultats de recherche ont été obtenus, mais dans les applications réelles de désamérisation, il existe des problèmes tels que la faible résistance à l'acide des enzymes immobilisées, la séparation lente du jus ou la séparation incomplète, etc. En ce qui concerne les problèmes susmentionnés, l'article suivant présentera un travail de recherche en détail. Dans ce travail, les chercheurs ont utilisé un matériau composite composé de chitosane, de Fe3O4 et de la silice, et a modifié le matériau composite avec des groupes époxy, puis a immobilisé la naringinase sur ce matériau. Ce travail fournira des données de base pour des études ultérieures sur la technologie d'immobilisation de la naringinase.
Contactez-nous dès maintenant !
Si vous avez besoin de Price, veuillez indiquer vos coordonnées dans le formulaire ci-dessous. Nous vous contacterons généralement dans les 24 heures. Vous pouvez également m'envoyer un courriel info@longchangchemical.com pendant les heures de travail ( 8:30 am to 6:00 pm UTC+8 Mon.~Sat. ) ou utilisez le chat en direct du site web pour obtenir une réponse rapide.
| Composé Glucoamylase | 9032-08-0 |
| Pullulanase | 9075-68-7 |
| Xylanase | 37278-89-0 |
| Cellulase | 9012-54-8 |
| Naringinase | 9068-31-9 |
| β-Amylase | 9000-91-3 |
| Glucose oxydase | 9001-37-0 |
| alpha-amylase | 9000-90-2 |
| Pectinase | 9032-75-1 |
| Peroxydase | 9003-99-0 |
| Lipase | 9001-62-1 |
| Catalase | 9001-05-2 |
| TANNASE | 9025-71-2 |
| Elastase | 39445-21-1 |
| Uréase | 9002-13-5 |
| DEXTRANASE | 9025-70-1 |
| L-Lactique déshydrogénase | 9001-60-9 |
| Déshydrogénase malate | 9001-64-3 |
| Cholestérol oxydase | 9028-76-6 |
